Cùng xem Rượu Etylic C2H6O tính chất hoá học, công thức cấu tạo rượu Etylic và bài tập – hoá 9 bài 44 trên youtube.
Rượu Etylic C2H6O thu được sau khi lên men gạo, sắn, ngô đã nấu chín hoặc quả nho, quả táo,… điều này cho thấy rượu etylic là khá phổ biến và chúng ta cũng đã gặp rất nhiều lần trong thực tế.
Vậy rượu Etylic C2H6O có tính chất hoá học gì, công thức cấu tạo của etylic như thế nào, làm sao điều chế được rượu etylic,… chúng ta cùng tìm hiểu chi tiết qua bài viết dưới đây.
Bạn đang xem: Rượu Etylic C2H6O tính chất hoá học, công thức cấu tạo rượu Etylic và bài tập – hoá 9 bài 44
I. Tính chất vật lý của rượu Etylic C2H6O
– Rượu etylic là chất lỏng không màu, sôi ở 78,3 C
– Nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic hòa tan được nhiều chất như iot, benzen,…
– Độ rượu: là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước.
* Công thức: Độ rượu = .100
– Trong đó V là thể tích đo bằng ml hoặc lít.
II. Cấu tạo phân tử của rượu Etylic C2H5OH
* Công thức cấu tạo của Etylic:
* Công thức cấu tạo rút gọn của etylic: CH3-CH2-OH
– Trong phân tử, rượu etylic có một nguyên tử H không kiên kết với nguyên tử C mà liên kết với nguyên tử oxi tạo ra nhóm –OH. Chính nhóm –OH này làm cho rượu có tính chất hóa học đặc trưng.
III. Tính chất hoá học của rượu etylic C2H5OH
1. Etylic C2H5OH tác dụng với oxi, phản ứng cháy
– Rượu Etylic cháy với ngọn lửa màu xanh, toả nhiều nhiệt
C2H5OH + 3O2
2CO2 + 3H2O
2. Etylic C2H5OH tác dụng với kim loại mạnh K, Na
– Thả mẩu Na vào cốc đựng rượu rượu etylic, mẩu natri tan dần và có bọt khí thoát ra
2C2H5OH + Na → 2C2H5ONa + H2↑
3. Etylic C2H5OH phản ứng với axit axetic
– Đổ rượu etylic vào cốc đựng axit axetic với xúc tác H2SO4 đặc, tạo thành dung dịch đồng nhất. Đun nóng hỗn hợp một thời gian, trong ống nghiệm xuất hiện chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
C2H5OH + CH3COOH 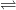
Etylic axit axetat Etylaxetat
IV. Ứng dụng của Etylic C2H5OH
– Rượu etylic được dùng làm nhiên liệu cho động cơ ô tô, cho đèn cồn trong phòng thí nghiệm.
Xem Thêm : Hình nền 3D cực đẹp
– Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp.
– Dùng pha chế các loại rượu uống.
V. Điều chế Etylic C2H5OH
* Phương pháp 1: Điều chế rượu làm đồ uống
– Cho tinh bột hoặc đường glucozo ![small xrightarrow[]{men-ruou}](https://hayhochoi.vn/uploads/news/wyswyg/2021_03/1617087835qofwi2nww1.gif)
C6H12O6 ![small xrightarrow[]{men-ruou}](https://hayhochoi.vn/uploads/news/wyswyg/2021_03/1617087835qofwi2nww1.gif)
* Phương pháp 2: Sản xuất rượu phục vụ ngành công nghiệp
– Cho etilen cộng hợp với nước có xúc tác là axit
C2H4 + H2O ![small xrightarrow[]{axit}](https://hayhochoi.vn/uploads/news/wyswyg/2021_03/161708783646tnmhhpay.gif)
VI. Bài tập về Etylic C2H5OH
* Bài 2 trang 139 sgk hoá 9: Trong số các chất sau: CH3 – CH3, CH3 – CH2OH, C6H6, CH3 – O – CH3 chất nào tác dụng được với Na? Viết phương trình hóa học.
* Lời giải bài 2 trang 139 sgk hoá 9:
– Chỉ có rượu Etylic phản ứng với Na theo PTPƯ:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
* Bài 3 trang 139 sgk hoá 9: Có ba ống nghiệm: Ống 1 đựng rượu etylic ống 2 đựng rượu 96o, ống 3 đựng nước. Cho Na dư vào các ống nghiệm trên, viết các phương trình hóa học.
* Lời giải bài 3 trang 139 sgk hoá 9:
– Các phương trình phản ứng hóa học:
* Ống 1: Rượu etylic tác dụng với Na
2C2H5OH + 2Na → 2C2H5ONa + H2↑
* Ống 2: Rượu 96o tác dụng với Na ⇒ gồm C2H5OH và H2O tác dụng với Na
2H2O + 2Na → 2NaOH + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
* Ống 3: Nước tác dụng với Na
2H2O + 2Na → 2NaOH + H2↑
* Bài 4 trang 139 sgk hoá 9: Trên các chai rượu đều có ghi các số, thí dụ 45o, 18o, 12o.
a) Hãy giải thích ý nghĩa của các số trên.
b) Tính số ml rượu etylic có trong 500ml chai rượu 45o.
c) Có thể pha được bao nhiêu lít rượu 25o từ 500ml rượu 45o.
* Lời giải bài 4 trang 139 sgk hoá 9:
a) Các con số 45o, 18o, 12o có nghĩa là trong 100ml có rượu 45ml, 18ml, 12ml rượu nguyên chất.
Xem Thêm : Tuyển tập những bài văn mẫu lớp 9 hay nhất – Download.vn
b) Số ml rượu etylic có trong 500ml rượu 45o là: 500.(45/100) = 225 ml.
c) Theo câu b): Trong 500ml rượu 45o có 225ml rượu nguyên chất.
⇒ Số ml rượu 25o pha chế được từ 500ml rượu 45o (hay từ 225ml rượu nguyên chất) là: 225.(100/25) = 900ml.
* Bài 5 trang 139 sgk hoá 9: Đốt cháy hoàn toàn 9,2g rượu etylic.
a) Tính thể tích khí CO2 tạo ra ở điều kiện tiêu chuẩn.
b) Tính thể tích không khí (ở điều kiện tiêu chuẩn) cần dùng cho phản ứng trên biết oxi chiếm 20% thể tích của không khí.
* Lời giải bài 5 trang 139 sgk hoá 9:
a) Phương trình hoá học của phản ứng:
C2H6O + 3O2 to→ 2CO2 + 3H2O.
1 mol 3 mol 2 mol 3 mol.
0,2 mol 0,6 mol 0,4 mol
– Theo bài ra ta có nC2H6O = 9,2/46 = 0,2 (mol)
– Theo PTPƯ: nCO2 = 2.nC2H6O = 2.0,2 = 0,4 (mol)
⇒ VCO2 (đktc) = 0,4.22,4 = 8,96 (lít)
b) Theo PTPƯ: nO2 = 3.nC2H6O = 0,6 (mol) ⇒ VO2 (đktc) = 0,6. 22,4 = 13,44 (lít)
– Vì oxi chiếm 20% thể tích không khí nên: VKK = (13,44.100)/20 = 67,2 (lít).
Hy vọng với phần ôn tập hệ thống lại kiến thức về tính chất hoá học, công thức cấu tạo của rượu etylic C2H5OH ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Rượu Etylic C2H6O tính chất hoá học, công thức cấu tạo rượu Etylic và bài tập – hoá 9 bài 44. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn


![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_03/1617087835nawb3vps24.gif)



