Cùng xem Saccarozơ trạng thái tự nhiên, Tính chất hóa học và Ứng dụng của Saccarozơ – Hóa 9 bài 51 trên youtube.
Saccarozơ là loại được phổ biến có trong nhiều loại thực vật, là nguyên liêu cho công nghiệp thực phẩm, thức ăn cho con người và pha chế thuốc trong y học.
Vậy Saccarozơ có tính chất hóa học và tính chất vật lý gì? trạng thái tự nhiên của saccarozơ tồn tại ra sao và được ứng dụng trong đời sống như thế nào? chúng ta cùng tìm hiểu qua bài viết này.
Bạn đang xem: Saccarozơ trạng thái tự nhiên, Tính chất hóa học và Ứng dụng của Saccarozơ – Hóa 9 bài 51
I. Trạng thái tự nhiên của Saccarozơ
– Saccarozơ có nhiều trong các loại thực vật như: mía, củ cải đường, thốt nốt,…

II. Tính chất vật lý của Saccarozơ
– Saccarozơ C12H22O11 là chất rắn kết tinh không màu, vị ngọt, tan nhiều trong nước, đặc biệt là trong nước nóng.
III. Tính chất hóa học của Saccarozơ
– Phản ứng thủy phân trong môi trường axit
C12H22O11 + H2O ![small xrightarrow[]{axit, t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1581524066ric7zgd0j8_1632651879_1632652448.gif)
Saccarozo Glucozo Fructozo
– Để chứng minh sản phẩm sau thủy phân có chứa Glucozơ người ta tiến hành cho dung dịch vào AgNO3 trong amoniac có xuất hiện kết tủa Ag màu trắng sáng, theo phương trình phản ứng sau:
C6H12O6 + Ag2O
C6H12O7 + 2Ag↓
IV. Ứng dụng của Saccarozơ
– Saccarozơ được ứng dụng làm nguyên liêu cho công nghiệp thực phẩm, thức ăn cho con người và pha chế thuốc trong y học.
V. Bài tập về Saccarozơ
* Bài 1 trang 155 SGK Hóa 9: Khi pha nước giải khát có nước đá người ta có thể làm như sau:
a) Cho nước đá vào nước, cho đường, rồi khuấy.
b) Cho đường vào nước, khuấy tan, sau đó cho nước đá.
Hãy chọn cách làm đúng và giải thích.
° Lời giải bài 1 trang 155 SGK Hóa 9:
– Cách b) là cách làm đúng vì khi chưa cho nước đá vào, đường sẽ dễ tan hơn do nhiệt độ của nước trong cốc chưa bị hạ xuống (Nhiệt độ càng cao càng dễ tan).
* Bài 2 trang 155 SGK Hóa 9: Hãy viết các phương trình hóa học trong sơ đồ chuyển hóa sau: Saccarozơ → Glucozơ → Rượu etylic.
° Lời giải bài 2 trang 155 SGK Hóa 9:
– Phương trình hóa học Saccarozơ → Glucozơ:
C12H22O11 + H2O → C6H12O6 + C6H12O6
– Phương trình hóa học Glucozơ → Rượu etylic.
C6H12O6 → 2C2H5OH + 2CO2
* Bài 3 trang 155 SGK Hóa 9: Hãy giải thích tại sao khi để đoạn mía lâu ngày trong không khí ở đầu đoạn mía thường có mùi rượu etylic.
° Lời giải bài 3 trang 155 SGK Hóa 9:
– Khi để đoạn mía lâu ngày trong không khí, đường saccarozơ có trong mía sẽ bị vi khuẩn và hơi nước có trong không khí lên men chuyển thành glucozơ, sau đó thành rượu etylic theo thứ tự PTHH sau:
Xem Thêm : GUI là gì? Có những thành phần nào? Một số ví dụ về GUI
C12H22O11 + H2O → C6H12O6 + C6H12O6
C6H12O6 → 2C2H5OH + 2CO2
* Bài 4 trang 155 SGK Hóa 9: Nêu phương pháp hóa học phân biệt ba dung dịch sau: glucozơ, rượu etylic, saccarozơ.
° Lời giải bài 4 trang 155 SGK Hóa 9:
• Lấy mẫu thử cho từng chất và đánh số thứ tự:
• Cho các mẫu thử tác dụng với Ag2O trong dung dịch NH3.
– Chất nào có phản ứng tráng bạc đó là glucozơ (có chất màu xám bám lên thành ống nghiệm)
PTHH: C6H12O6 + Ag2O ![small xrightarrow[]{NH_{3}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1581525288bhe0gujo37_1632651879_1632652449.gif)
– Còn lại là rượu etylic và saccarozơ.
• Cho vào 2 mẫu thử dung dịch HCl sau đó đun nóng tiến hành phản ứng thủy phân, lấy sản phẩm thủy phân đem tác dụng với dung dịch AgNO3/NH3.
– Sản phẩm nào tạo kết tủa trắng thì ban đầu là Saccarozo (Do saccarozo thủy phân ra glucozo và tham gia phản ứng tráng bạc tạo kết tủa Ag) theo thứ tự PTHH sau:
C12H22O11 + H2O ![small xrightarrow[]{H^{+},t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1581525290wyl1l269yf_1632651879_1632652449.gif)
C6H12O6 + Ag2O ![small xrightarrow[]{NH_{3}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1581525288bhe0gujo37_1632651879_1632652449.gif)
– Không có hiện tượng thì ban đầu là rượu etylic.
* Bài 5 trang 155 SGK Hóa 9: Từ 1 tấn nước mía chứa 13% saccarozơ có thể thu được bao nhiêu kg saccarozơ? Cho biết hiệu suất thu hồi đường đạt 80%.
° Lời giải bài 5 trang 155 SGK Hóa 9:
– Trong 1 tấn mía chứa 13% saccarozơ có: 1.(13/100) = 0,13 tấn saccarozơ.
Xem Thêm : 2NO + O2 → 2NO2 | , Phản ứng oxi-hoá khử
– Khối lượng saccarozơ thu được: (13/100).(80/100) = 0,104 (tấn) = 104 (kg).
* Bài 6 trang 155 SGK Hóa 9: Khi đốt cháy một loại gluxit (thuộc một trong các chất sau: glucozơ, saccarozơ), người ta thu được khối lượng H2O và CO2 theo tỉ lệ 33: 88. Xác định công thức của gluxit trên.
° Lời giải bài 6 trang 155 SGK Hóa 9:
– Qua công thức glucozơ: C6H12O6 và saccarozơ C12H22O11 ta nhận thấy nH = 2nO nên ta đặt công thức của gluxit là CnH2mOm.
– Phản ứng đốt cháy:
CnH2mOm + nO2 → nCO2 + mH2O.
– Thu được khối lượng H2O và CO2 theo tỉ lệ 33 : 88 ⇒ tỉ lệ số mol H2O và CO2 là:
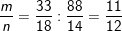
– Công thức phù hợp là C12H22O11.
Hy vọng với bài viết về Saccarozơ trạng thái tự nhiên, Tính chất hóa học và Ứng dụng của Saccarozơ ở trên giúp các em hiểu rõ hơn. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để DONGNAIARTvà ghi nhận, chúc các em học tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Saccarozơ trạng thái tự nhiên, Tính chất hóa học và Ứng dụng của Saccarozơ – Hóa 9 bài 51. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn

![small xrightarrow[]{NH_{3}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/15815240680nsi065kg0_1632651879_1632652449.gif)



