Cùng xem Acid Base Reactions In Organic Chemistry – Master Organic Chemistry trên youtube.
giới thiệu về phản ứng axit-bazơ trong hóa học hữu cơ
- Antimon Là Gì? Giá Antimon Thỏi Hết Bao nhiêu Tiền? | CÔNG TY CỔ PHẦN TẬP ĐOÀN NGỌC THIÊN GLOBAL
- Tổng hợp những chương trình khuyến mãi siêu hấp dẫn tại Thabet
- chứng chỉ tin học trình độ a
- Đơn xin việc mẫu chuẩn nhất full trọn bộ file word 2021
- NH3 là gì? Tính chất, Nguồn gốc, ứng dụng, cách điều chế & lư ý khi dùng
Bây giờ chúng tôi đã mô tả cách tìm ra vị trí của các điện tử trong phân tử, các yếu tố ổn định điện tích âm và điện tích dương, và chúng tôi đã đi vào hình thức mũi tên cong cho các phản ứng, chúng tôi đã sẵn sàng bắt đầu tìm hiểu sâu hơn. chi tiết hơn về một số phản ứng chính trong hóa học hữu cơ.
Hãy bắt đầu với phản ứng axit-bazơ.
mục lục
- bốn thành phần của mỗi phản ứng axit-bazơ
- điều gì tạo nên phản ứng axit-bazơ thuận lợi? (gợi ý: nó liên quan đến sự ổn định của bazơ liên hợp)
- tính axit của phân tử liên quan trực tiếp đến khả năng của bazơ liên hợp trong việc ổn định điện tích âm
- bất cứ điều gì yếu tố làm bền bazơ liên hợp sẽ dẫn đến tăng tính axit
- phản ứng axit-bazơ đi từ anion kém bền hơn (tức là bazơ hơn) sang anion bền hơn (tức là ít bazơ hơn) thuận lợi về mặt năng lượng
1. bốn thành phần của mọi phản ứng axit-bazơ trong hóa học hữu cơ
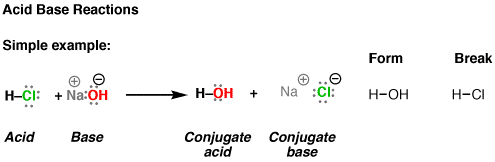
Trong bài đăng đầu tiên của tôi về phản ứng axit-bazơ, tôi chỉ nói rằng trình tự đầu tiên của công việc kinh doanh là tìm ra những liên kết nào được hình thành và những liên kết nào bị phá vỡ, đồng thời nhận ra bốn thành phần. như thế này.
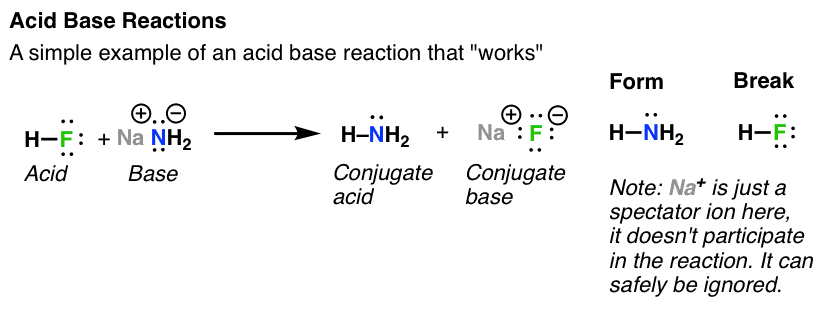
- phân tử đạt được h + được gọi là axit
- phân tử đạt được h + được gọi là bazơ
- sau khi thu được h +, bazơ trở thành axit liên hợp
- sau khi mất h +, axit trở thành bazơ liên hợp.
2. điều gì làm cho phản ứng axit-bazơ thuận lợi? (gợi ý: nó liên quan đến sự ổn định của cơ sở liên hợp)
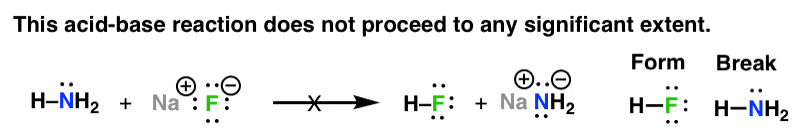
Mặc dù điều này giúp chúng tôi nhận ra mẫu, nhưng nó không thực sự giúp chúng tôi trả lời “tại sao?”. Ví dụ, tại sao phản ứng trên diễn ra tốt, nhưng phản ứng tiếp theo thì không? xét cho cùng, phản ứng axit-bazơ cũng mang tính kỹ thuật.
Bây giờ chúng ta có thể quay lại và bắt đầu giải quyết câu hỏi quan trọng này.
Xem Thêm : List làm chứng chỉ định giá xây dựng
Hãy bắt đầu với một số ví dụ đơn giản. đây là bốn ví dụ về phản ứng axit-bazơ. Nếu bạn đọc về sự ổn định điện tích âm sớm hơn, bạn sẽ có thể đánh giá cái nào trong số này sẽ thuận lợi hơn và cái nào kém thuận lợi hơn. (vui lòng bỏ qua mũi tên quay lại bây giờ)
3. tính axit của phân tử liên quan trực tiếp đến khả năng của bazơ liên hợp để ổn định điện tích âm
hãy nhìn vào điều này và suy nghĩ về nó:
- Trong mỗi phản ứng, phân tử ở ngoài cùng bên trái là axit, sẽ cho một proton vào nước (bazơ), tạo thành h3o (+) [axit liên hợp] và một anion (bazơ liên hợp) .
- lưu ý sự thay đổi của các điện tích: trong mỗi trường hợp, bazơ liên hợp âm hơn axit và axit liên hợp dương hơn bazơ. điều này luôn đúng với axit-bazơ các phản ứng.
- vì mỗi phản ứng ở đây liên quan đến h2o và h3o (+), sự khác biệt duy nhất giữa mỗi phản ứng là danh tính của axit và bazơ liên hợp.
- những thứ khác bằng nhau, phân tử trung tính bền hơn so với bazơ liên hợp của nó (bản chất cho) để giảm thiểu chi phí). sự khác biệt về độ ổn định giữa các phân tử trung tính (ở bên trái) là nhỏ so với sự khác biệt về độ ổn định giữa các phân tử mang điện (ở bên phải).
- do đó, hãy hiểu các yếu tố làm ổn định điện tích âm là sẽ là chìa khóa để hiểu cái nào thuận lợi hơn và cái nào kém thuận lợi hơn.
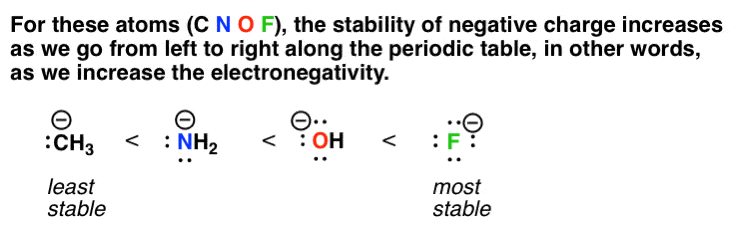
Nếu bạn nhớ các yếu tố làm ổn định điện tích âm , khi chúng ta đi từ trái sang phải trong bảng tuần hoàn, chúng ta nhận được xu hướng này:
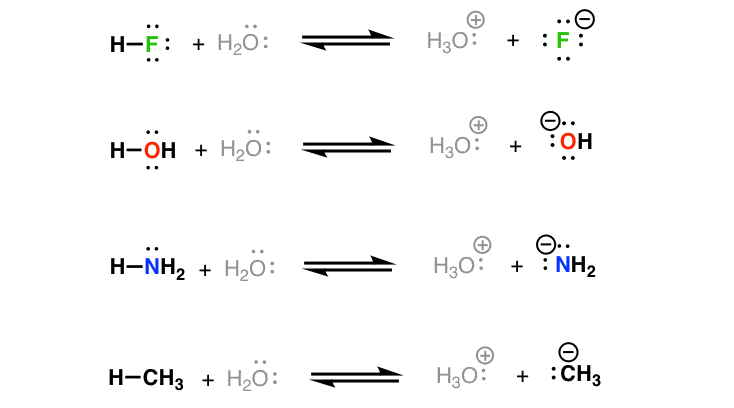
do đó, trong số bốn loài được liệt kê trong các phản ứng ở trên, chúng ta nên kỳ vọng h-f là loài có nhiều khả năng từ bỏ proton của nó để tạo thành cơ sở liên hợp của nó, f (-). nói cách khác, h-f có tính axit mạnh nhất vì bazơ liên hợp của nó có nhiều khả năng ổn định điện tích âm hơn.
Trong số bốn loài này, ch3 (-) là loài kém ổn định nhất.
do đó, trong số bốn loài được liệt kê, chúng ta nên mong đợi h-ch3 là loài ít nhất từ bỏ proton của nó để tạo thành cơ sở liên hợp, ch3 (- ). nói cách khác, h-ch3 là ít axit nhất.
4. bất kỳ yếu tố nào làm ổn định bazơ liên hợp sẽ dẫn đến tăng tính axit
hãy lặp lại điều này, theo một cách khác. Tính axit của một loài liên quan trực tiếp đến sự ổn định của bazơ liên hợp của nó.
Xem Thêm : Các cách copy bản vẽ cad sang cad
xin lỗi vì đã la hét, nhưng điều này rất quan trọng! Tôi rất phấn khích, tôi phải hét lên điều này.
Trong một thời gian dài, tôi có thể quay lại bảy yếu tố ổn định điện tích âm (điện tích, độ âm điện, độ phân cực, cộng hưởng, hiệu ứng cảm ứng, obitan và độ thơm) và nhìn chúng qua lăng kính này. bất kỳ xu hướng nào dẫn đến sự ổn định của điện tích âm sẽ có tác động trực tiếp đến tính axit. Cụ thể hơn, việc ổn định điện tích âm sẽ làm cho axit liên hợp có tính axit cao hơn.
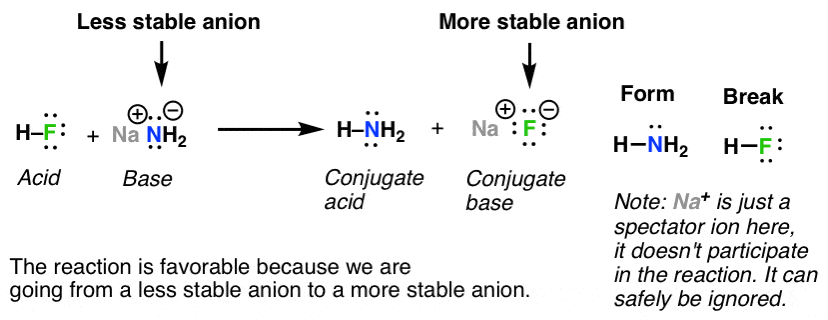
5. phản ứng axit-bazơ đi từ anion kém bền hơn (tức là bazơ hơn) sang anion bền hơn (tức là ít bazơ hơn) thuận lợi về mặt năng lượng
Vì vậy, đối với phản ứng ở đầu, chúng ta đi từ anion kém bền hơn (h2n-) sang anion bền hơn (f-). điều này thuận lợi về mặt năng lượng giống như nước chảy xuống dốc. để phản ứng này tiếp tục.
Phản ứng ngược sẽ liên quan đến việc chuyển từ anion bền hơn (f-) sang anion kém bền hơn (h2n-). điều này không đủ năng lượng và không tiến hành một cách thỏa đáng.
Tất nhiên, điều này vẫn còn khá mơ hồ vào lúc này; thực sự, chúng ta có thể chính xác hơn nhiều về nó, như chúng ta sẽ thấy. Tuy nhiên, trong bài đăng tiếp theo, chúng ta sẽ xem xét các phản ứng giống hệt nhau từ một góc độ hơi khác.
bài tiếp theo: ôn tập về phản ứng axit-bazơ (2) – tính bazơ
ghi chú
các bài viết liên quan
- bảy yếu tố ổn định điện tích âm
- đánh giá phản ứng axit-bazơ (2) – tính bazơ
- 5 yếu tố chính ảnh hưởng đến tính axit
- Phản ứng axit-bazơ: giới thiệu về ka và pka
- cách sử dụng bảng pka
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tổng hợp
Lời kết: Trên đây là bài viết Acid Base Reactions In Organic Chemistry – Master Organic Chemistry. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn