Cùng xem Oxit là gì? Tính chất hóa học và hướng dẫn giải bài tập oxit – GhGroup trên youtube.
Chắc hẳn trong chúng ta ai cũng đã từng nghe đến từ oxit, nhưng ít ai biết đến nó, bởi oxit không được ứng dụng nhiều trong đời sống. Vậy hôm nay chúng ta cùng nhau tìm hiểu oxit là gì, một số dạng và tính chất hóa học quan trọng của oxit cũng như cách gọi tên của oxit nhé!
1. Định nghĩa oxit là gì?
Oxit là hợp chất chứa 1 nguyên tố oxi
Oxit là hợp chất chứa hai nguyên tố, trong đó có một nguyên tố là oxi.
Ví dụ: Khi đốt cháy p trong oxi, nó tạo thành hợp chất (p2o5), là một oxit.
2. Công thức chung của oxit
Công thức hóa học chung của oxit là: mxoy.
Trong đó: Theo quy tắc hóa trị gồm ký hiệu hóa học của oxi o có chỉ số y và ký hiệu hóa học của nguyên tố m có chỉ số x (hóa trị n): ii.y = n.x
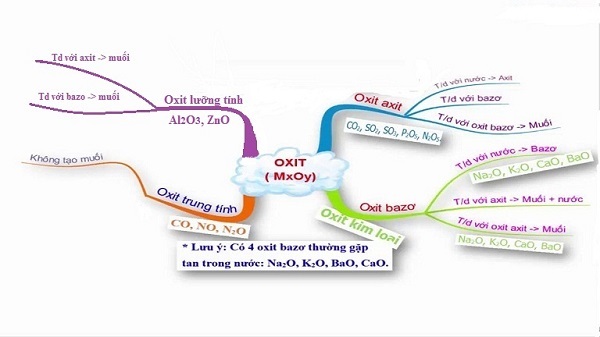
Oxit được chia làm 4 loại: oxit bazơ, oxit axit, oxit lưỡng tính và oxit trung tính.
2.1 Oxit bazơ
Oxit bazơ là hợp chất gồm một hay nhiều nguyên tử kim loại kết hợp với một hay nhiều nguyên tử oxi và bazơ tương ứng. Oxit bazơ tan trong nước gồm kim loại kiềm (li, na, k,…) và kim loại kiềm thổ (mg, ca, ba,…), trừ be.
Oxit bazơ tác dụng với axit tạo thành muối và nước. Một số oxit bazơ phản ứng với nước tạo thành bazơ tan, gọi là bazơ.
Ví dụ:na2o – xút, fe2o3 – fe(oh)3…
2.2 Oxit axit
Oxit axit được gọi là anhiđrit axit, phản ứng với nước tạo thành axit và phản ứng với bazơ tạo thành muối hóa học. Oxit axit thường là oxit của phi kim tương ứng với axit hoặc kim loại hóa trị cao
Ví dụ: mn2o7 – hmno4, co2 – h2co3, p2o5 – h3po4.
Oxit được chia thành 4 loại: oxit bazơ, oxit axit, oxit lưỡng tính và oxit trung tính
2.3 Oxit lưỡng tính
Đó là một oxit khi phản ứng với dung dịch kiềm và tạo thành muối và nước khi phản ứng với dung dịch axit.
Ví dụ: al2o3, zno.
2.4 Oxit trung tính
Oxit trung tính hay còn gọi là oxit không tạo muối là oxit không phản ứng với axit, bazơ hay nước.
Ví dụ: Carbon Monoxide – co, Nitric Oxide – Không, …
3. Cách gọi tên oxit
Bây giờ chúng ta đã biết oxit là gì, hãy học cách đặt tên cho nó. Hiện nay có nhiều cách gọi tên oxit nhưng nhìn chung cách gọi tên oxit của chúng ta vẫn có thể chia ra như sau:
3.1 Tên oxit=tên nguyên tố+oxit
Kiểu ghi này thường chỉ áp dụng cho kim loại, phi kim chỉ có đơn giá
Ví dụ:
k2o: kali oxit
Không phải: Nitơ Oxit
Cao: Canxi ôxít
al2o3: nhôm oxit
na2o: natri oxit
3.2 Danh pháp oxit kim loại đa hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
Điều này phù hợp để gọi tên oxy với các hợp chất kim loại đa hóa trị.
Ví dụ:
feo là một oxit gọi là “oxit sắt (ii)”
fe2o3 là một oxit gọi là “sắt(iii) oxit”
3.3 Cách gọi tên oxit phi kim đa hóa trị
Tên oxit = tiền tố đầu tiên (còn gọi là tiền tố) + tên phi kim loại + tiền tố thứ hai (tiền tố) + oxit
Xem Thêm : Tài liệu học 3ds max từ cơ bản đến nâng cao
tiền tố: – mono: có nghĩa là 1.
– đi: có nghĩa là 2.
– tri : có nghĩa là 3
– tetra: nghĩa là 4.
– penta : có nghĩa là 5.
Ví dụ:
so2: sulfur dioxide; co2: carbon dioxide; n2o3: nitơ trioxide; n2o5: nitơ pentoxide.
4. Tính chất hóa học của oxit
Tính chất hóa học của oxit
Các oxit khác nhau về tính chất hóa học. Sau đây ghgroup.com.vn sẽ gửi đến các bạn tính chất hóa học của một số oxit quan trọng hiện nay.
4.1 Tính chất hóa học của oxit axit
Các oxit axit phản ứng với nước: Ngoại trừ silica, hầu hết các oxit axit đều tan trong nước tạo thành dung dịch axit:
- na2o + h2so4 → na2so4 + h2o
- feo + hcl → fecl2 + h2o cuo + h2so4 → cuso4 + h2o
- so3 + cao -> caso4
- p2o5 +3na2o -> 2na3po4
- naoh +so2 -> nahso3 (phản ứng tạo muối axit)
- 2koh +so3 -> k2so3 +h2o (phản ứng tạo muối trung hòa)
- co2 +ca(oh)2 ->caco3 (tạo muối trung hòa)
- sio2 + ba(oh)2 ->basio3 (phản ứng tạo muối axit)
- p2o5 +6naoh ->2na2hpo4 +h2o
- p2o5 +4naoh ->2nah2po4 +h2o
- cao(r) + h2o → ca(oh)2 (dd)
- bao(r) + h2o → ba(oh)2 (dd)
- cuo(r) + 2hcl(dd) → cucl2(dd) + h2o (lỏng)
- bao(r) + co2(k) → baco3(r)
- Phương trình hóa học
- Giải pháp
- Phương trình phản ứng
- Giải pháp
- Bài toán phản ứng của oxit kiềm với dung dịch axit
- Bài tập phản ứng giữa oxit với nước
Phản ứng của oxit axit với oxit bazơ tan: Phản ứng của oxit axit với oxit bazơ tan tạo thành muối:
Phản ứng của oxit axit với bazơ tan: Theo tỉ lệ mol oxit axit và bazơ, phản ứng tạo ra nước + muối trung hòa, muối axit hoặc hỗn hợp 2 muối:
– Đối với kim loại gốc i:
Tỷ lệ mol b:oa là 1:
Tỷ lệ mol b:oa là 2:
– Đối với kim loại kiềm hóa trị II:
Tỷ lệ mol của oa:b là 1:
Tỷ lệ mol của oa:b là 2:
Đối với axit có hóa trị axit-bazơ iii:
Tỷ lệ mol b:oa là 6:
Tỷ lệ mol b:oa là 4:
Tỷ lệ mol b:oa là 2:
4.2 Tính chất hóa học của oxit bazơ
Oxit bazơ phản ứng với nước: Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ mới phản ứng với nước. Đó là 4 oxit sau: na2o, cao, k2o, bảo.
Ví dụ:
Các oxit bazơ phản ứng với axit: Hầu hết các oxit bazơ phản ứng với axit để tạo thành muối và nước.
Đánh vần: kiềm oxit + axit -> muối + nước
Oxit bazơ tác dụng với oxit axit: Chỉ một số oxit bazơ tác dụng với oxit axit tạo thành muối. Thông thường đó là những oxit axit (na2o, cao, k2o, bao) phản ứng với nước.
Đánh vần: oxit bazơ + oxit axit -> muối
5. Một số dạng chuyển động liên kết với oxit
Một số bài tập liên quan đến oxit thường xuyên xuất hiện trong các đề thi không chỉ ở cấp THCS mà còn ở cả cấp THPT. Vì vậy ghgroup.com.vn xin chia sẻ một số câu hỏi luyện tập liên quan đến oxit giúp các bạn ôn luyện và nâng cao kiến thức để hoàn thành bài thi một cách chính xác nhất.
5.1 Bài tập oxi hóa axit với bazơ
Trường hợp 1: Khi oxit axit (co2, so2…) phản ứng với dung dịch kiềm (koh, naoh…)
co2 + nah → naco3 (1)
co2 + 2naoh → na2co3 + h2o (2)
Xem Thêm : Cong thuc tinh pH – Các công thức tính nồng độ pH hay nhất
Bước 1: Xét tỉ lệ mol của bazơ với oxit axit, giả sử t
-Nếu t 1: Sản phẩm thu được là muối axit, chỉ xảy ra phản ứng (1)
– Nếu 1 < t < 2: Sản phẩm thu được là muối axit và muối trung hòa chứng tỏ 2 phản ứng (1) và (2) xảy ra đồng thời
– Nếu t ≥ 2: Sản phẩm thu được là muối trung hòa, tức là chỉ xảy ra phản ứng (2).
bước 2: Viết phương trình phản ứng và tính theo phương trình (nếu đồng thời xảy ra cả 2 phản ứng thì cần ẩn, giải theo hệ phương trình)
bước 3: Từ tổ hợp các phương trình hóa học, hãy vận dụng định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố,… để trả lời các câu hỏi đã cho
Trường hợp 2: Khi oxit axit (co2, so2…) phản ứng với dung dịch kim loại kiềm thổ (ca(oh)2, ba(oh)2…)
co2 + ca(oh)2 → caco3 + h2o (1)
2co2 + ca(oh)2 → ca(hco3)2 (2)
Bước 1: Xem xét tỷ lệ
– Nếu t ≤ 1: Sản phẩm thu được là muối trung hòa (phản ứng (1))
– Nếu 1 < t < 2: Sản phẩm thu được là muối axit và muối trung hòa (phản ứng (1) và (2))
– Nếu t ≥ 2: Sản phẩm thu được là muối axit (xảy ra phản ứng (2)).
Bước thứ hai và thứ ba tương tự như Trường hợp 1.
5.2 Một số bài tập khác
Để thực hiện bài tập này, bạn cần thực hiện các bước sau:
+ viết phương trình
+ Xác định số mol của một chất đã cho
+ Từ phương trình hóa học, vận dụng một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải yêu cầu của bài toán.
Ví dụ: Để hòa tan hoàn toàn 10 gam mgozơ cần dùng vừa đủ 400 ml dung dịch HCl thu được dung dịch x. Giá trị của a là
Mô tả chi tiết:
nmgo = 0,25 nốt ruồi
mgo + 2hcl → mgcl2 + h2o
0,25 → 0,5 nốt ruồi
=>Nồng độ của dung dịch axit clohidric là
cm=nv=0.50.4=1.25m
Ví dụ: Cho 20 gam hỗn hợp gồm na2o và cuo thì dùng hết 3,36 lít so2 (đktc). Sau phản ứng thu được chất rắn không tan. Thành phần phần trăm khối lượng của hai oxit trong hỗn hợp là:
Mô tả chi tiết:
Phương trình phản ứng: na2o + so2 → na2so3
nna2o = nso2=3,36:22,4=0,15(mol)
%mna2o=0,15.62/20×100%=46.5%
⇒%mcuo=53,5%
(Lưu ý rằng cuo không phản ứng với so2)
Trên đây là những thông tin về oxit mà ghgroup.com.vn chia sẻ. Hi vọng qua bài viết trên các bạn đã biết oxit là gì? Danh pháp và tính chất hóa học cơ bản của oxit. và một số loại chuyển động oxit. Nếu còn bất kỳ thắc mắc nào về oxit hay bất kỳ loại hóa chất nào, đừng ngại liên hệ với chúng tôi qua số hotline 0916047878 – 0974.245.670 để được giải đáp nhé!
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Oxit là gì? Tính chất hóa học và hướng dẫn giải bài tập oxit – GhGroup. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn