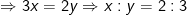Cùng xem Ôn tập về Phi kim, Sơ lược bảng tuần hoàn nguyên tố hóa học và bài tập luyện tập – Hóa 9 bài 32 trên youtube.
Ở các bài viết trước, các em đã được học về tính chất của phi kim, các phi kim thường gặp như Clo, Cacbon, Các oxit của cacbon, axit cacbonic và muối cacbonat; Silic, công nghiệp silicat.
Bài viết này chúng ta sẽ cùng ôn tập kiến thức đã học về phi kim, cấu tạo và ý nghĩa bảng tuần hoàn các nguyên tố hóa học, qua đó vận dụng để giải một số bài tập về phi kim.
Bạn đang xem: Ôn tập về Phi kim, Sơ lược bảng tuần hoàn nguyên tố hóa học và bài tập luyện tập – Hóa 9 bài 32
I. Kiến thức cần nhớ
1. Tính chất hóa học của phi kim (sơ đồ 1)

a) Tính chất hóa học của Clo (sơ đồ 2)
b) Tính chất hóa học của Cacbon (sơ đồ 3)
3. Sơ lược bảng tuần hoàn các nguyên tố hóa học
– Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
– Cấu tạo bảng tuần hoàn gồm có ô nguyên tố, chu kỳ và nhóm.
– Sự biến đổi tính chất của các nguyên tố trong chu kỳ (2,3) và nhóm (I,VII)
– Ý nghĩa của bảng tuần hoàn là: Biết vị trí suy ra cấu tạo nguyên từ và tính chất của nguyên tố. Biết cấu tạo nguyên tử suy ra vị trí và tính chất của nguyên tố.
II. Bài tập luyện tập về Phi kim và sơ lược bảng tuần hoàn các nguyên tố hóa học
* Bài 1 trang 103 SGK Hóa 9: Căn cứ vào sơ đồ tính chất hóa học của phi kim (sơ đồ 1). Hãy viết phương trình hóa học với phi kim cụ thể là lưu huỳnh.
* Lời giải:
– Các phương trình phản ứng của lưu huỳnh:
(1) S + H2 ![xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/16118279268fj2l34ojf_1611861422.gif)
(2) 3S + 2Al ![xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/16118279268fj2l34ojf_1611861422.gif)
(3) S + O2 ![xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/16118279268fj2l34ojf_1611861422.gif)
* Bài 2 trang 103 SGK Hóa 9: Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của clo căn cứ theo sơ đồ tính chất hóa học của phi kim cụ thể Clo (sơ đồ 2).
* Lời giải:
– Các phương trình phản ứng của Clo:
(1) H2 + Cl2 ![xrightarrow[]{as'}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926gnu74df8r4_1611861422.gif)
(2) 2Fe + 3Cl2
![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(3) Cl2 + 2NaOH → NaCl + NaClO + H2O
(4) Cl2(k) + H2O(l) ↔ HCl(dd) + HClO(dd)
* Bài 3 trang 103 SGK Hóa 9: Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong phản ứng đó.
* Lời giải:
– PTHH biểu diễn tính chất hóa học của cacbon và một số hợp chất khác:
(1) C(r) + CO2 (k) ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(2) C(r) + O2 (k) ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(3) CO + CuO ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
Xem Thêm : Phân tích nhân vật Mị trong vợ chồng A Phủ chi tiết, dễ hiểu
(4) CO2(k) + C(r) ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(5) CO2(k) + CaO(r) ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(6) CO2(k) + 2NaOH(dd) dư → Na2CO3(r) + H2O(l)
CO2 (k) + NaOH (dd) đủ → NaHCO3
(7) CaCO3 (r) ![dpi{100} fn_cm xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2021_01/1611827926xi8kwhpphb_1611861423.gif)
(8) Na2CO3(r) + 2HCl(dd) → 2NaCl(dd) + CO2(k)↑ + H2O(l)
NaHCO3 (r) + HCl (dd) → NaCl(dd) + CO2(k) + H2O(l)
– Vai trò của C trong phản ứng (1), (2) và (4) là chất khử (chất chiếm oxi).
* Bài 4 trang 103 SGK Hóa 9: Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
– Cấu tạo nguyên tử của A.
– Tính chất hóa học đặc trưng của A.
– So sánh tính chất hóa học của A với các nguyên tố lân cận.
* Lời giải:
a) Cấu tạo nguyên tử của A:
– Số hiệu nguyên tử của A là 11 cho biết: natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
b) Tính chất hóa học đặc trưng của natri:
– Nguyên tố natri ở đầu chu kì là hai kim loại mạnh, tròn phản ứng hóa học, natri là chất khử mạnh.
– Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
– Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2↑
– Tác dụng với nước: Nguyên tố Na ngoài tính chất hóa học chung của kim loại còn có tính chất hóa học đặc trưng là tác dụng với H2O ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2↑
– Tác dụng với dung dịch muối: Na + dung dịch CuSO4
2Na + 2H2O → 2NaOH +H2↑
2NaOH + CuSO4 → Cu(OH)2↓ +Na2SO4
c) So sánh tính chất hóa học của Na với các nguyên tố lân cận:
– Na có tính chất hóa hoc mạnh hơn Mg (nguyên tố sau Na), mạnh hơn Li (nguyên tố trên Na) nhưng yếu hơn K (nguyên tố dưới Na).
* Bài 5 trang 103 SGK Hóa 9: a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32g oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4g chất rắn.
Biết khối lượng mol của oxit sắt là 160 gam.
b) Chất khí sinh ra được hấp thụ hoàn toàn trong dung dịch nước vôi trong có dư. Tính khối lượng kết tủa thu được.
* Lời giải:
a) Gọi công thức của oxit sắt là: FexOy
– Phương trình hóa học:
FexOy + yCO → xFe + yCO2 (1)
Xem Thêm : Những bài văn tả con đường hay nhất | Văn mẫu lớp 5 – Đọc Tài Liệu
1 (mol) y (mol) x (mol) y (mol)
0,4/x 0,4(mol)
– Theo bài ra, ta có:
– Theo phương trình phản ứng trên, ta có:
– Lại có:
Vậy CTHH của oxit sắt: Fe2O3.
b) Khí sinh ra CO2
– Phương trình hóa học:
Fe2O3 + 3CO → 2Fe + 3CO2↑ (1)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (2)
1(mol) 1(mol) 1(mol) 1(mol)
0,6(mol).
– Theo ptpư (1) thì:
– Theo ptpư (2) ta suy ra: nCaCO3 = nCO2 = 0,6 (mol)
⇒ Khối lượng kết tủa thu được là: mCaCO3 = n.M = 0,6.100 = 60(g).
* Bài 6 trang 103 SGK Hóa 9: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
* Lời giải:
– Theo bài ra, ta có:
– Bài ra: VNaOH = 500ml = 0,5 (lít) ⇒ nNaOH = CM.V= 0,5.4 = 2 (mol).
– Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
– Theo phương trình phản ứng, ta có: nCl2 = nMnO2 = 0,8 (mol).
Cl2 + 2NaOH → NaCl + NaClO + H2O.
– Ta thấy:
⇒ NaOH dư, Cl2 phản ứng hết, nên mọi tính toán tính theo số mol Cl2 (tức là tính nNaCl và nNaClO theo nCl2).
– Theo phương trình phản ứng: nNaCl = nNaClO = nCl2 = 0,8 (mol).
CM(NaCl)= CM(NaClO) = n/V = 0,8/0,5 = 1,6 mol/l.
– Cũng theo theo ptpư, ta có: nNaOH (pư) = 2.nCl2 = 2.0,8 = 1,6 (mol).
– Suy ra số mol NaOH dư là: nNaOH (dư) = 2 – 1,6 = 0,4(mol).
⇒ Nồng độ mol/l của NaOH dư là: CM(NaOH dư) = n/V = 0,4/0,5 = 0,8 (mol/l).
Như vậy với bài viết ôn tập về Phi kim, Sơ lược bảng tuần hoàn nguyên tố hóa học và bài tập luyện tập ở trên. Hayhochoi hy vọng đã hệ thống lại một cách tốt nhất để các em dễ dàng tiếp thu và ghi nhớ, đặc biệt là việc vận dụng vào giải các bài tập cụ thể.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Ôn tập về Phi kim, Sơ lược bảng tuần hoàn nguyên tố hóa học và bài tập luyện tập – Hóa 9 bài 32. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn