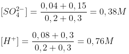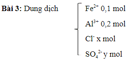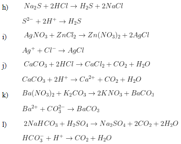Cùng xem Các Dạng Bài Tập Hoá 11 Chương Sự Điện Li Cần Nắm Vững trên youtube.
Trong chương trình Điện hóa học 11, chương Điện hóa học chứa đựng những kiến thức trọng tâm của toàn bộ Học kì 1. Vì vậy, các em không chỉ cần nắm vững lý thuyết mà còn phải nắm vững các bài tập trong chương 1 dưới đây. và đầy đủ các dạng bài tập hóa học chương 1.
i. bài tập hóa học 11: chất điện li. viết phương trình điện li
1. chủ đề:
bài tập hóa học 11
2. giải pháp:
gợi ý 1:
– lý thuyết:
+ Những chất tan trong nước (hoặc nóng chảy) phân ly thành ion được gọi là chất điện li. axit, bazơ và muối là chất điện li.
+ Chất điện li mạnh là chất khi tan trong nước sẽ phân li thành các ion, bao gồm:
axit mạnh: hcl, hno3, h2so4, hbr, hi, hclo4, hclo3, … dung dịch bazơ: naoh, koh, ca (oh) 2, ba (oh) 2, … hầu hết các muối. phương trình điện li của chất điện li mạnh sử dụng mũi tên một chiều (→).
+ Chất điện li yếu là chất khi tan trong nước chỉ một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch, bao gồm:
các axit trung bình và yếu như: h2s, h2co3, h3po4, ch3cooh … các bazơ không tan như: mg (oh) 2, fe (oh) 2, fe (oh) 3 … phương trình điện li của các chất điện li yếu sử dụng mũi tên hai chiều ().
– chất điện ly mạnh: ca (oh) 2, ch3coona, h2so4, mgso4, hi, naclo3, nahco3, kno3, nh4cl, hno3, na2s, hclo4, hcl, kmno4, khso4, kal (so4) 2,12h2o.
– chất điện ly yếu: ch3cooh, hclo, h2s, h2so3, hno2, h3po4, h3po3, hf.
bài 2: dựa trên định luật bảo toàn điện tích: tổng điện tích dương bằng tổng điện tích âm.
a) k2cro4 b) fe (no3) 3 c) mg (mno4) 2 d) al2 (so4) 3 e) na2s f) ba (oh) 2 g) nh4cl h) ch3coone
bản nhạc 3:
– lý thuyết: axit làm quỳ tím hóa đỏ, bazơ làm xanh quỳ tím. riêng với muối, tùy theo cấu trúc mà ứng với các môi trường khác nhau.
chúng tôi có bảng sau:
muối
môi trường
(nacl, k2so4, ..)
(alcl3, feso4,…)
(na2co3, k2so3,…)
– quỳ đỏ: nh4cl, fecl3, al2 (so4) 3.
– quỳ tím chuyển sang xanh lam: ch3coona, k2co3, na2s, na2co3,
– quỳ tím không đổi màu: ba (no3) 2 nacl.
ii. bài tập hóa học 11: tính nồng độ các ion trong dung dịch
1. chủ đề:
bài tập hóa học 11
2. giải pháp:
bài đăng 1:
0,01 0,01 0,01 mol
0,01 0,02 0,01 mol
gợi ý 2:
0,04 0,08 0,04
0,15 0,3 0,15
bản nhạc 3:
a)
0,01 0,01 mol
b)
0,1 0,1 mol
0,02 0,04 mol
0,3 0,3 mol
c)
1,68 3,36 1,68 mol
iii. bài tập hóa học 11: xác định muối từ các ion đã cho trong dung dịch
dạng 3: xác định muối từ các ion đã cho trong dung dịch
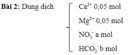
Có 4 dung dịch, mỗi dung dịch chỉ chứa một loại cation và một loại anion. Các loại ion trong 4 dung dịch gồm: Ba2 +, Mg2 +, Pb2 +, Na +, So42-, Cl-, Co32-, No3-. 4 giải pháp là gì?
người chiến thắng:
8 ion kết hợp với nhau tạo thành 4 dung dịch muối tan. ion tạo ra muối ít hòa tan nhất được coi là đầu tiên.
của cation, pb2 + chỉ kết hợp với no3- để tạo thành một muối hòa tan. => pb (not3) 2.
ba2 + kết tủa với co32- và so42- nên muối tan sẽ là bacl2.
mg2 + kết tủa với co32- nên muối tan sẽ là mgso4, phần còn lại sẽ là na2co3.
iv. các dạng bài tập hóa học 11: vận dụng nguyên tắc bảo toàn điện tích
1. chủ đề:
bài tập hóa học 11
2. giải pháp:
công thức chung :
cách tính điện tích mol:
Xem Thêm : 20 Cách viết Content Thu hút Hấp dẫn siêu Hay cho người mới – Tmarketing
khối lượng chất tan:
áp dụng định luật bảo toàn điện tích, chúng ta thu được:
áp dụng định luật bảo toàn điện tích, chúng ta thu được:
⬄ (1)
⬄
⬄ 
trong tổng số (1) và (2) = & gt; a = b = 0,1 mol.
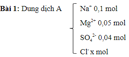
áp dụng định luật bảo toàn điện tích, chúng ta thu được:
trong tổng số (1) và (2) = & gt; x = 0,2 mol y = 0,3 mol.
v. các dạng bài tập hóa học 11: bài tập về axit – bazơ. tính pH của dung dịch
1. chủ đề:

bài tập hóa học 11
2. giải pháp:
dạng 5: bài tập về axit-bazơ. ph của giải pháp
bài tập 1: – tính ph: if [h +] = 10-a, then ph = a
ph = -log [h +]
ph + poh = 14.
1)
0,04 0,04m
ph = -log [h +] = 1,4.
2)
0,01 0,02 m
0,05 0,05m
ph = -log [h +] = -log [0,02 + 0,05] = 1,15.
3)
10-3 10-3 mét
poh = -log [oh-] = -log [10-3] = 3.
= & gt; ph = 14 – 3 = 11.
4)
0,1 0,1m
0,2 0,4m
poh = -log [oh-] = -log [0,1 + 0,4] = 0,3.
= & gt; pH = 14 – 0,3 = 13,7.
làn 2: nhcl = 0,1 mol
nnaoh = 0,15 mol
PTHH:
trước p: 0,1 0,15
p>: 0,1 0,1
sau p: 0,05.
[oh-] dư = 0,05: 0,5 = 0,1 m
poh = -log [oh-] = 1
= & gt; ph = 14 – 1 = 13.
PTHH:
trước p: 0,03 0,032
p>: 0,03 0,03
sau pư: 0,002 mol
[oh-] dư = 0,002: 0,2 = 0,01 phút
poh = -log [oh-] = 2
= & gt; ph = 14 – 2 = 12.
gợi ý 4: ph = 13 = & gt; poh = 14 – 13 = 1.
pthh:
0,15 0,15 mol
Xem Thêm : Top Việc Làm Thêm Cho Học Sinh Và Những Điều Cần Lưu Ý
mna = 0,15,23 = 3,45 g.
gợi ý 5:
a) ph = 3 = & gt; po = 11
[h +] = 10-3; [oh-] = 10-11.
b) giảm ph đi 1 = & gt; [h +] tăng thêm 10 = & gt; v giảm 10 lần.
cần giảm thể tích của h2o đi 9 / 10đv để thu được dung dịch có pH = 2.
c) ph tăng 1 = & gt; [h +] giảm 10 = & gt; v tăng gấp 10 lần.
cần thêm một thể tích h2o bằng 9đv để thu được dung dịch có pH = 4.
? lưu ý : khi pha loãng chất tan số mol không thay đổi
Sau phản ứng, dung dịch có pH = 2 = & gt; còn lại h +.
[h +] rest = 10-2 = & gt; noh- dư = 10-2. 0,5 = 0,005 mol.
pthh:
0,0075 0,025
0,0075 0,0075 0,0075
lượng mưa =
là. bài tập hóa học 11: viết pt ion
1. chủ đề:
dạng 6: viết
bài tập hóa học 11
2. giải pháp:
gợi ý 1:
bản nhạc 2:
vii. bài tập hóa học 11: nhận biết
1. chủ đề:
dạng 7: nhận ra
bài tập hóa học 11
2. giải pháp:
bài đăng 1:
pt:
kết tủa trắng
không khí bốc lên
kết tủa trắng
gợi ý 2:
viii. bài tập hóa học 11: phản ứng trao đổi ion
gợi ý 1:
a) lượng mưa =
vgas =
0,03 0,03 0,03 mol
0,1 0,1 0,1 mol
áp dụng định luật bảo toàn điện tích:
b) 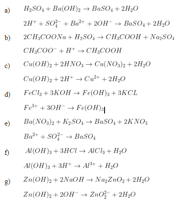
bản nhạc 2:
b) Lấy 50ml dung dịch a, ta thu được (số mol giảm đi 1/5):
0,0025 0,005 0,0025
0,005 0,01 0,005
0,01 0,01 0,02 mol
pthh:
trước p: 0,01 0,0075
p>: 0,0075 0,0075 0,0075
sau p: 0,0025 0,0075
m1 = lượng mưa = 0,0075.233 = 1,7475g
trước p: 0,005 0,02
p>: 0,005 0,005 0,005
sau p: 0,015
các ion có trong dung dịch:
k +: 0,01 mol
ba2 +: 0,0025 mol
ồ-: 0,015 mol
Trên đây là những bài giải bài tập Hóa học 11 cơ bản chương 1 nhưng giúp các em nhớ lại các kiến thức trọng tâm của chương, từ đó có thể vận dụng để giải các bài tập nâng cao hơn. . Chúc các bạn mọi điều tốt lành!
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tổng hợp
Lời kết: Trên đây là bài viết Các Dạng Bài Tập Hoá 11 Chương Sự Điện Li Cần Nắm Vững. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn