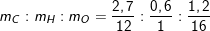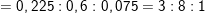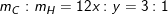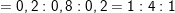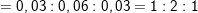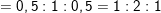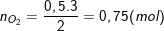Cùng xem Bài tập về Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4 và cách giải – hoá lớp 9 trên youtube.
Về Hidrocacbon trong nội dung kiến thức hoá 9, các em đã nắm được tính chất hoá học, đặc điểm và công thức cấu tạo của các hợp chất tiêu biểu như Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4.
Vì vậy, nắm vững nội dung lý thuyết và giải bài tập thành thạo về các hợp chất Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4sẽ giúp các em dễ dàng tiếp thu các kiến thức ở bậc THPT về Ankan, Anken, Ankin,… và các hợp chất hữu cơ khác.
Bạn đang xem: Bài tập về Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4 và cách giải – hoá lớp 9
Đối với việc giải bài tập về Axetilen, Etilen, Benzen , Metan thì có 2 dạng cơ bản: Thứ nhất là vận dụng lý thuyết để so sánh tính chất hoá học và vật lý giữa metan, etilen, axetilen và benzen, hoặc nhận biết các lọ hoá chất mất nhãn, hoàn thành chuỗi phản ứng… Thứ hai là giải toán dựa vào các phương trình phản ứng (với hidrocacbon phổ biến là phản ứng cháy) để lập công thức phân tử, công thức cấu tạo, tìm lượng chất,…
Trong bài viết này, chúng ta cùng giải một số bài toán về hidrocacbon với các hợp chất điểm hình trong nội dung hoá 9 là Axetilen, Etilen, Benzen và Metan.
I. Bài tập về HidroCacbon
Bài 1: Lập công thức phân tử của hợp chất hữu cơ X. Biết X chứa C,H,O và có phân tử khối là 60. Khi đốt cháy hoàn toàn 4,5g X thu được 9,9 (g) khí CO2 và 5,4 (g) H2O.
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ta có:nCO2 = 9,9/44 = 0,225 (mol); nH2O = 5,4/18 = 0,3 (mol)
⇒ mC = 0,225.12 = 2,7(g)
⇒ mH = 0,3.2 = 0,6(g)
– Cũng theo bài ra thì 4,5g A gồm C, H, O ⇒ mO = 4,5 – 2,7 – 0,6 = 1,2(g)
– Ta lập tỉ lệ:
⇒ CTPT của X có dạng là (C3H8O)n
– Theo bài ra, phân tử khối của X là 60 nên: MX = 36n+8n+16n = 60 ⇒ n = 1
⇒ CTPT của X là: C3H8O
Bài 2: Khi phân tích một hiđrocacbon, người ta thấy Hiđro chiếm 25% khối lượng. Xác định công thức phân tử của hiđrocacbon, biết M = 16g.
* Lời giải:
– Gọi công thức phân tử hidrocacbon là CxHy,
– Theo bài ra: M = 16 ⇒ 12x + y = 16 (*)
– Hidro chiếm: mH = 25% ⇒ mC =75% nên có:
⇒ 12x = 3y ⇒ y = 4x (**)
– Từ (*) và (**) ta được: x = 1 và y = 4
⇒ CTPT của hidrocacbon là: CH4
Bài 3: Đốt cháy 6,4 gam chất hữu cơ A thu được 8,8 g CO2 và 7,2 g H2O. Biết MA = 32. Tìm công thức phân tử của A?
*Lời giải:
– Theo bài ta có:nCO2 = 8,8/44 = 0,2 (mol); nH2O = 7,2/18 = 0,4 (mol)
⇒ mC = 0,2.12 = 2,4(g)
⇒ mH = 0,4.2 = 0,8(g)
– Theo bài ra, 6,4g A gồm C, H, O ⇒ mO = 6,4 – 2,4 – 0,8 = 3,2(g)
– Ta lập tỉ lệ:
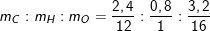
– Công thức phân tử của A có dạng: (CH4O)n
– Ta lại có : MA = 12n+4n+16n=32 ⇒ n = 1
⇒ CTPT của A là: CH4O
Bài 4: Đốt cháy 0,9g chất hữu cơ A, người ta thu được 1,32g CO2 và 0,54g H2O. Biết A có phân tử khối là 180g. Xác định công thức phân tử của A.
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra ta có: nCO2 = 1,32/44 = 0,03 (mol); nH2O = 0,54/18 = 0,03 (mol).
⇒ mC = 0,03.12 = 0,36(g)
⇒ mH = 0,03.2 = 0,06(g)
– Theo bài ra, 0,9g A gồm C, H, O ⇒ mO = 0,9 – 0,36 – 0,06 = 0,48 (g).
– Ta lập tỉ lệ:
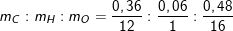
– Công thức A có dạng (CH2O)n
– Theo bài ra: MA = 180 = 12n+2n+16n=180 ⇒ n = 6
– Công thức phân tử của A là: C6H12O6
Bài 5: Đốt cháy hết 11,2 lít khí X (đktc) thu được 11,2 lít CO2 đktc và 9g H2O. Biết phân tử khối của X=30g. Tìm công thức phân tử, viết công thức cấu tạo X?
* Lời giải:
– Theo bài ta có: nCO2 = 11,2/22,4 = 0,5 (mol); nH2O = 9/18 = 0,5 (mol).
⇒ mC = 0,5.12 = 6(g)
⇒ mH = 0,5.2 = 1(g)
– Theo bài ra, nX = 11,2/22,4 = 0,5(mol)
– Mà khối lượng phân tử của X = 30 ⇒ mX = 0,5.30 = 15(g).
– Mà X gồm C, H, O ⇒ mO = 15 – 6 – 1 = 8(g).
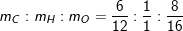
– Công thức là (CH2O)n
⇒ MX = 30 = 12n+2n+16n ⇒ n = 1
– Vậy công thức phân tử là CH2O
Bài 6: Đốt cháy hoàn toàn 1,15 g một chất hữu cơ X, sau phản ứng thu được 1,12 lít CO2 (đktc) và 1,35g H2O.Xác định công thức phân tử của X. Biết tỉ khối hơi của X so với khí O2 là 1,4375.
* Lời giải:
– Theo bài ta có: nCO2 = 1,12/22,4 = 0,05 (mol); nH2O = 1,35/18 = 0,075 (mol)
⇒ mC = 0,05.12 = 0,6(g)
⇒ mH = 0,075.2 = 0,15(g)
– Theo bài ra, suy ra 1,15g A gồm C, H, O ⇒ mO = 1,15 – 0,6 – 0,15 =0,4g
mC : mH : mO =0,6/12 : 0,15/1 : 0,4/16 = 0,05 : 0,15 : 0,025 = 2:6:1
– Công thức phân tử là (C2H6O)n
– Ta có: 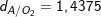
– Công thức phân tử là: C2H6O
II. Bài tập Về Etilen C2H4
Bài 1: Đốt cháy V lít etylen, thu được 9g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc)?
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra, thu được 9g H2O ⇒ nH2O = 9/18 = 0,5(mol).
– PTPƯ đốt cháy Etilen:
C2H4 + 3O2 → 2CO2 + 2H2O
1 3 2 2 (mol)
? 0,5 (mol)
– Theo PTPƯ:
⇒ VO2 = 0,75.22,4 = 16,8(lít).
– Vì thể tích oxi chiếm 20% thể tích không khí nên ⇒ VKK = 5.VO2 = 5.16,8 = 84 (lít).
Bài 2: Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibrometan.
a) Viết PTPƯ xảy ra.
b) Tính thành phần phần trăm của hỗn hợp theo thể tích.
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
a) Khi cho hỗn hợp metan và etilen qua dd Brom chỉ có etilen tham gia phản ứng.
– Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2 (1)
b) Tính thành phần phần trăm của hỗn hợp theo thể tích
– Gọi x, y lần lượt là số mol của metan và etilen
– Theo bài ra, hỗn hợp metan và etilen (đktc) là 2,8 lít nên
⇒ nhh = 2,8/22,4 = 0,125(mol).
⇒ x + y = 0,125 (*)
Xem Thêm : Lissandra mùa 12: Bảng Ngọc và Cách lên đồ mới nhất
– Theo bài ra, khi phản ứng dd Brom dư (tức là C2H4 sẽ phản ứng hết) ta thu được 4,7g đibrometan ⇒ nC2H4Br2 = 4,7/188 = 0,025(mol).
– Theo PTPƯ (1) ở câu a) thì ta có: nC2H4 = y = nC2H4Br2 = 0,025(mol).
– Thế y = 0,025 và pt (*) ta được x = 0,125 – 0,025 = 0,1(mol).
⇒ nCH4 = 0,1.22,4 = 2,24(lít); nC2H4 = 0,025.22,4 = 0,56 (lít).
⇒ %VCH4 =% = 80%
⇒ %VC2H4 =% = 20%
Bài 3: Cho 5,6 lít (đktc) hỗn hợp CH4 và C2H4 đi qua nước brom dư thấy có 4g brom tham gia phản ứng.
a) Viết phương trình phản ứng xảy ra ?
b) Tính thành phần phần trăm thể tích mỗi chất đã dùng?
c) Tính thể tích O2 cần dùng để đốt cháy hoàn toàn hỗn hợp khí ban đầu?(đktc)
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
a) Khi cho hỗn hợp metan và etilen qua dd Brom chỉ có etilen tham gia phản ứng.
– Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2 (1)
b) Tính thành phần phần trăm của hỗn hợp theo thể tích
– Gọi x, y lần lượt là số mol của metan và etilen
– Theo bài ra, hỗn hợp metan và etilen (đktc) là 5,6 lít nên
⇒ nhh = 5,6/22,4 = 0,25(mol).
⇒ x + y = 0,25 (*)
– Theo bài ra, khi phản ứng dd Brom dư (tức là C2H4 sẽ phản ứng hết) ta thấy có 4g Br2 pư
⇒ nBr2 = 4/160 = 0,025(mol).
– Theo PTPƯ (1) ở câu a) thì ta có: nC2H4 = nBr2 = 0,025(mol).
– Thế y = 0,025 và pt (*) ta được x = 0,25 – 0,025 = 0,225(mol).
⇒ nCH4 = 0,225.22,4 = 5,04(lít); nC2H4 = 0,025.22,4 = 0,56 (lít).
⇒ %VCH4 = (5,04/5,6).100% = 90%
⇒ %VC2H4 =(0,56/5,6).100% = 10%
c) Tính V oxi dùng để đốt cháy hỗn hợp khí metan và etilen trên
CH4 + 2O2 → CO2 + 2H2O (1)
1 mol 2
0,225 ?
C2H4 + 3O2 → 2CO2 + 2H2O (2)
1 mol 3
0,025 ?
– Theo PTPƯ (1): nO2 (1) = 0,225.2 = 0,45 (mol)
– Theo PTPƯ (2): nO2 (2) = 0,025.3 = 0,075 (mol)
⇒ ∑nO2 = 0,45 + 0,075 = 0,525 (mol)
⇒ VO2 = 0,525.22,4 = 11,76(lít).
Bài 4: Đốt cháy hết 36 gam hh khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 (đktc)
a) Tính V mỗi khí ở (đktc).
b) Tính % mỗi khí trong hỗn hợp khí ban đầu
Bài 5: Đốt cháy hoàn toàn 1,68 lít hỗn hợp gồm 2 khí CH4 và C2H4. Dẫn toàn bộ khí sinh ra qua bình đựng dung dịch Ba(OH)2 dư thấy trong bình có 19,7g kết tủa.
a) Viết PTHH?
b) Tính thành phần % thể tích mỗi khí trong hỗn hợp?
c) Tính thể tích không khí đủ cho phản ứng cháy (đktc)?
Bài 6: Đốt cháy hoàn toàn 0,3 mol hỗn hợp gồm metan và etilen. Lấy toàn bộ CO2 sinh ra cho vào dd Ca(OH)2 dư thu được 40g kết tủa.
a) Viết PTPƯ xảy ra.
b) Tính % thể tích mỗi khí ban đầu?
III. Bài tập về AXETILEN
Bài 1: Cho 11,2 lít hỗn hợp metan và axetilen (đo ở đktc) đi qua dung dịch brom dư thấy có 8 gam Brom tham gia phản ứng :
a) Viết các phương trình phản ứng xảy ra.
b) Tính khối lượng C2H2Br4 thu được sau phản ứng.
c) Tính phần trăm về thể tích của mỗi khí trong hỗn hợp đầu.
* Lời giải:
a) Khi qua dd Brom chỉ có Axetilen tham gia phản ứng
C2H2 + 2Br2 → C2H2Br4 (1)
b) Tính khối lượng C2H2Br4
– Gọi x và y lần lượt là số mol metan và axetilen
– Theo bài ra 11,2 lít hỗn hợp metan và axetilen (đo ở đktc)
⇒ nhh = x + y = 11,2/22,4 = 0,5 (mol). (*)
– Theo bài ra, thu được 8g Brom phản ứng ⇒ nBr2 = 8/160 = 0,05(mol)
– Theo ptpư (1) thì: nC2H2Br4 = ½nBr2 = ½.0,05 = 0,025(mol).
⇒ mC2H2Br4 = 0,025.348 = 8,7(g).
c) Tính phần trăm về thể tích của mỗi khí
– Theo ptpư (1) thì nC2H2 = ½nBr2 = ½.0,05 = 0,025(mol).
⇒ y = 0,025 thế vào (*) ⇒ x = 0,0475
⇒ mC2H2 = 0,025.28 = 0,7(g).
⇒ mCH4 = 0,0475.16 = 0,76(g).
Bài 2: Đốt cháy hoàn toàn 16,8 lít khí axetilen.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Tính thể tích khí oxi, thể tích không khí cần dùng để đốt cháy hết lượng axetilen này. Biết rằng thể tích khí đo ở đktc và không khí chứa 20% thể tích oxi.
c) Tính khối lượng khí cacbonic và hơi nước tạo thành sau phản ứng.
d) Nếu dẫn sản phẩm đốt cháy vào dung dịch nước vôi trong dư thì sau thí nghiệm sẽ thu được bao nhiêu gam chất kết tủa?
Bài 3: Cho 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch Br2 dư, lượng Br2 đã tham gia phản ứng là 5,6 gam.
a) Hãy viết phương trình phản ứng ?
b) Tính thành phần % thể tích của mỗi khí trong hỗn hợp (biết Br = 80).
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
a) Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2 (1)
x x
C2H2 + 2Br2 → C2H2Br4 (2)
y 2y
b) Brom dư nên Etilen và Axetilen phản ứng hết
– Gọi x và y lần lượt là số mol của Etilen và Axetilen
– Theo bài ra, 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 nên ta có: nhh = 0,56/22,4 = 0,025(mol).
⇒ x + y = 0,025. (*)
– Theo bài ra, lượng Brom tham gia phản ứng là 5,6 gam nên: nBr2 = 5,6/160 = 0,035(mol).
– Theo PTPƯ (1) và (2) ta có: nBr2 = x + 2y = 0,035 (**)
– Giải hệ pt (*) và (**) ta được: x = 0,015 (mol); y = 0,01 (mol).
⇒ VC2H4 = 0,015.22,4 = 0,336(lít).
⇒ VC2H2 = 0,01.22,4 = 0,224(lít).
⇒ %VC2H4 = (0,336/0,56).100% = 60%.
⇒ %VC2H2 = (0,224/0,56).100% = 40%.
Bài 4: Đốt cháy một lượng hỗn hợp metan và axetilen thu được 13,2g CO2 và 5,4g H2O. Tính thành phần % theo thể tích mỗi khí trong hỗn hợp?
IV. Bài tập về Metan CH4
Bài 1: Khi đốt cháy hoàn toàn 3,36 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành ? (các khí đo ở đktc).
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra đốt cháy hoàn toàn 3,36 lít khí metan ⇒ nCH4 = 3,36/22,4 = 0,15 (mol).
– Ta có PTPƯ đốt cháy CH4:
CH4 + 2O2 → CO2 + 2H2O
1 mol 2 1 2
0,15 ? ?
– Theo PTPƯ ta có: nO2 = 2.nCH4 = 0,15.2 = 0,3(mol).
⇒ mO2 = 0,3.22,4 = 6,72 (lít).
– Theo PTPƯ ta có: nCO2 = nCH4 = 0,15(mol).
⇒ mCO2 = 0,15.22,4 = 3,36 (lít).
Bài 2: Đốt cháy hoàn toàn khí metan trong bình chứa 4,48 lít khí oxi. Hãy tính thể tích khí metan đã dùng, thể tích khí cacbonic tạo thành, khối lượng nước tạo thành ? (các khí đo ở đktc)
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra, 4,48 lít khí oxi ⇒ nO2 = 4,48/22,4 = 0,2(mol).
– Ta có PTPƯ đốt cháy CH4:
CH4 + 2O2 → CO2 + 2H2O
1 mol 2 1 2
? 0,2 ? ?
– Theo PTPƯ ta có: nCO2 = nCH4 = ½.nO2 = ½.0,2 = 0,1(mol); nH2O = nO2 = 0,2 (mol).
⇒ mCH4 = 0,1.16 = 1,6(g);
mCO2 = 0,1.44 = 4,4(g).
mH2O = 0,2.18 = 3,6(g).
Bài 3: Đốt cháy hoàn toàn khí metan trong bình chứa khí oxi vừa đủ thu được 11g khí cacbonic. Hãy tính thể tích khí metan đã dùng, khối lượng khí oxi đã dùng?
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra, thu được 11g CO2 ⇒ nCO2 = 11/44 = 0,25(mol).
– Ta có PTPƯ đốt cháy CH4:
CH4 + 2O2 → CO2 + 2H2O
1 mol 2 1 2
? ? 0,25 ?
– Theo PTPƯ ta có: nCH4 = nCO2 = 0,25(mol); nH2O = nO2 = 2.nCO2 = 2.0,25 = 0,5(mol).
⇒ mCH4 = 0,25.16 = 4(g);
mH2O = 0,5.18 = 9(g).
mO2 = 0,5.16 = 8(g).
Bài 4: Đốt cháy V lít khí metan, thu được 1,8g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc)?
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra, thu được 1,8g H2O ⇒ nH2O = 1,8/18 = 0,1(mol).
– Ta có PTPƯ đốt cháy CH4:
CH4 + 2O2 → CO2 + 2H2O
1 mol 2 1 2
? ? ? 0,1
– Theo PTPƯ: nCH4 = ½.nH2O = ½.0,1 = 0,05(mol).
⇒ Thể tích CH4 ở ĐKTC là: VCH4 = 0,05.22,4 = 1,12(lít).
– Theo PTPT thì nO2 = 2nCH4 = 2.0,05 = 0,1(mol)
⇒ VO2 = 0,1.22,4 = 2,24(lít).
– Vì thể tích oxi chiếm 20% thể tích của không khí nên ta có:
Vkk = (100/20).VO2. = 5.VO2 = 5.2,24 = 11,2(lít).
Bài 5: Đốt cháy hoàn toàn 2,24 lít khí C4H10 (đktc) rồi hấp thụ hết các sản phẩm cháy vào dung dịch Ba(OH)2 0,2M dùng dư thu được chất kết tủa.
a) Viết PTPƯ?
b) Tìm số g kết tủa thu được.
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Theo bài ra, thu được 2,24 lít C4H10 ở (đktc) ⇒ nC4H10 = 2,24/22,4 = 0,1(mol).
C4H10 + 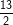
1 mol 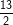
0,1 ? x? ?
CO2 + Ba(OH)2 → BaCO3↓trắng + H2O (2)
x x
– Theo PTPƯ (1), ta có: nCO2 = 4.nC4H10 = 4.0,1 =0,4(mol)
– Theo PTPƯ (2), ta có: nBaCO3 = nCO2 = 0,4(mol).
⇒ mBaCO3↓ = 0,4.197 = 78,8(g)
Bài 6: Đốt cháy 10,08 lít hỗn hợp khí CH4 và C2H6 thu được 14,56 lít CO2 (đktc)
a) Tính % mỗi khí trong hỗn hợp.
b) Dẫn toàn bộ sản phẩm cháy qua dung dịch Ba(OH)2 dư thu được m gam kết tủa. Tính m?
Xem Thêm : Năm 1975 mệnh gì? Tìm hiểu tử vi của người sinh năm 1975
* Lời giải:
– Gọi x và y lần lượt là số mol của CH4 và C2H6
– Theo bài ra có 10,08 lít CH4 và C2H6 (ở đktc) ⇒ nhh = x + y = 10,08/22,4 = 0,45(mol)
⇒ x + y = 0,45 (*)
– PTPƯ đốt cháy CH4 và C2H6
CH4 + 2O2 → CO2 + 2H2O
x mol x mol
C2H6 + 
y mol 2y mol
– Theo bài ra thì nCO2 = 14,56/22,4 = 0,65(mol).
– Theo 2 PTPƯ trên ta có: nCO2 = x + 2y
⇒ x + 2y = 0,65 (**)
– Giải hệ PT (*) và (**) ta được x = 0,25(mol), y = 0,2(mol).
⇒ mCH4 = 0,25.16 = 4(g)
⇒ mC2H6 = 0,2.30 = 6(g)
⇒ %mCH4 = .100% = 40%
⇒ %mC2H6 = .100% = 60%
b) Dẫn CO2 thu được qua Ba(OH)2 dư ta có PTPƯ
CO2 + Ba(OH)2 → BaCO3↓trắng + H2O
1 mol 1 mol
0,65 mol 0,65 mol
– Theo PTPƯ thì nCO2 = nBaCO3 = 0,65(mol).
⇒ mBaCO3 = 0,65.197 = 128,05(g).
– Vậy khối lượng kết tủa BaCO3 là 128,05(g).
V: Bài tập về Benzen C6H6
Bài 1: Biết rằng benzen cũng có phản ứng thế với clo như với brom. Cho clo dư tác dụng với 78 g benzen (có mặt bột sắt) thu được 78g clobenzen. Tính hiệu suất của phản ứng ?
Bài 2: Cho benzen tác dụng với brom có xúc tác là bột sắt, thu được 3,925 g brombenzen. Tính khối lượng các chất tham gia phản ứng, biết hiệu suất của phản ứng là 75%?
Hy vọng với bài viết hệ thống Bài tập về Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4 và cách giải ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại thông tin dưới phần bình luận để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Bài tập về Axetilen C2H2, Etilen C2H4, Benzen C6H6, Metan CH4 và cách giải – hoá lớp 9. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn