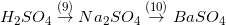Cùng xem Tính chất hoá học của Oxit, Axit, Bazo và Muối – Hoá lớp 9 trên youtube.
Oxit axit và Oxit bazơ và Muối là một trong những kiến thức mở đầu của môn hoá học 9, đây là một trong những nội dung kiến thức quan trọng mà các em cần nắm vững.
Để học tốt được môn hoá, các em cần đặc biệt ghi nhớ tính chất hoá học của các nguyên tố và các hợp chất. Bài viết này sẽ giúp các em hệ thống lại tính chất hoá học của Oxit, Axit, Bazơ và Muối và vận dụng giải một số bài tập.
Bạn đang xem: Tính chất hoá học của Oxit, Axit, Bazo và Muối – Hoá lớp 9
I. Tính chất hoá học của Oxit bazơ
1. Oxit bazơ tác dụng với nước H2O
– Một số Oxit bazo tác dụng với nước tạo thành dung dịch bazo (kiềm)
PTPƯ: Oxit bazo + H2O → Bazo
Ví dụ: BaO(r) + H2O(dd) → Ba(OH)2,(dd)
Na2O + H2O(dd) → 2NaOH
CaO + H2O(dd) → Ca(OH)2
– Một số oxit bazo khác tác dụng với nước như: K2O, Li2O, Rb2O, Cs2O, SrO,…
2. Oxit bazo tác dụng với Axit
– Oxit bazo tác dụng với axit tạo thành muối và nước
PTPƯ: Oxit bazo + Axit → Muối + H2O
Ví dụ: CuO(r) + HCl(dd) → CuCl2,dd + H2O
BaO + 2HCl → BaCl2 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
3. Oxit bazo tác dụng với Oxit axit
– Một số oxit bazo (là những oxit bazo tan trong nước) tác dụng với oxit axit tạo thành muối
PTPƯ: Oxit bazo + Oxit axit → Muối
Ví dụ: CaO + CO2 → CaCO3
BaO + CO2 → BaCO3
II. Tính chất hoá học của Oxit axit
1. Oxit axit tác dụng với nước H2O
– Nhiều Oxit axit tác dụng với nước tạo thành dung dịch axit
PTPƯ: Oxit axit + H2O → Axit
Ví dụ: P2O5 (r) + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
– Những oxit axit tác dụng được với nước và do đó cũng tan trong nước.
2. Oxit axit tác dụng với bazo
– Oxit axit tác dụng với bazo tạo thành muối và nước
PTPƯ: Oxit axit + Bazơ → Muối + H2O
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ba(OH)2 → BaSO3 + H2O
3. Oxit axit tác dụng với oxit bazơ
– Oxit axit tác dụng với một số oxit bazơ (tan) tạo thành muối.
Ví dụ: CO2 + BaO → BaCO3
III. Tính chất hoá học của Axit
1. Axit làm đổi màu giấy quỳ tím
– Dung dịch axit làm đổi màu giấy quỳ tím thành đỏ
2. Axit tác dụng với kim loại
+ Axit tác dụng với kim loại tạo thành muối và giải phóng khí Hyđro H2
PTPƯ: Axit + Kim loại → Muối + H2↑
+ Điều kiện xảy ra phản ứng:
– Axit: thường dùng là HCl, H2SO4 loãng (nếu là H2SO4 đặc thì không giải phóng H2; nội dung này sẽ học ở bậc THPT)
– Kim loại: Đứng trước H trong dãy hoạt động hóa học của kim loại:
Dãy điện hoá kim loại:
K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
Cách nhớ: Khi Nào Cần Mua Áo Záp Sắt Nhìn Sang Phải Hỏi Cửa Hàng Á Pi Âu
Ví dụ: 2Na + 2HCl = 2NaCl + H2↑
Mg + H2SO4 (loãng) = MgSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2↑
– Chú ý: Sắt khi tác dụng với HCl, H2SO4 loãng chỉ tạo muối sắt (II) chứ không tạo muối sắt (III) (phản ứng không mạnh nên không tạo muối sắt (III), muối sắt (III) tạo ra khi phản ứng với H2SO4 đặc nóng).
3. Axit tác dụng với bazo
– Axit tác dụng với bazo tạo thành muối và nước
PTPƯ: Axit + Bazo → Muối + H2O
– Điều kiện: Tất cả các axit đều tác dụng với bazơ. Phản ứng xảy ra mãnh liệt và được gọi là phản ứng trung hòa.
Ví dụ: NaOH + HCl → NaCl + H2O
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
Cu(OH)2 + H2SO4 (loãng) → CuSO4 + 2H2O
4. Axit tác dụng với Oxit bazơ
– Axit tác dụng với Oxit bazơ tạo thành muối và nước
PTPƯ: Axit + Oxit bazơ → Muối + H2O
– Điều liện: Tất cả các axit đều tác dụng với oxit bazơ.
Ví dụ: Na2O + 2HCl = 2NaCl + H2O
FeO + H2SO4(loãng) = FeSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
5. Axit tác dụng với muối
– Muối (tan) + Axit (mạnh) → Muối mới (tan hoặc không tan) + Axit mới (yếu hoặc dễ bay hơi hoặc mạnh).
– Điều kiện phản ứng:
+ Muối tham gia tan, Axit mạnh, muối tạo thành không tan trong axit sinh ra
+ Chất tạo thành có ít nhất 1 kết tủa (ký hiệu:↓) hoặc một khí bay hơi (ký hiệu: ↑)
+ Sau phản ứng, nếu muối mới là muối tan thì axit mới phải yếu, nếu muối mới là muối không tan thì axit mới phải là axit mạnh.
Ví dụ: H2SO4 + BaCl2 = BaSO4↓ + 2HCl
K2CO3 + 2HCl = 2KCl + H2O + CO2
Lưu ý: (H2CO3 không bền và phân hủy ra H2O và CO2)
IV. Tính chất hoá học của Bazơ
1. Bazo tác dụng với chất chỉ thị màu
– Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
– Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2. Bazo tác dụng với oxit axit
– Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Xem Thêm : Tổng quan
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
3. Bazơ tác dụng với axit
– Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
4. Bazơ tác dụng với muối
– Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
5. Bazơ phản ứng phân huỷ
– Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Ví dụ: Cu(OH)2
CuO + H2O
2Fe(OH)3 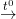
V. Tính chất hóa học của muối
1. Tác dụng với kim loại
+ Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tác dụng với axit
+ Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ: BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với dung dịch muối
+ Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ: AgNO3 + NaCl → NaNO3 + AgCl↓
4. Tác dụng với dung dịch bazơ
+ Dung dịch bazơ có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Phản ứng phân hủy muối
+ Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ: 2KClO3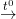
CaCO3 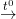
VI. Phản ứng trao đổi trong dung dịch
1. Định nghĩa:
+ Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhay những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
+ Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ: CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không xảy ra.
Lưu ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Ví dụ: H2SO4 + 2NaOH → Na2SO4 + 2H2O
VII. Bài tập về Oxit, Axit, Bazo và Muối
Bài 1 trang 14 sgk hóa 9: Từ Mg, MgO, Mg(OH)2 và dung dịch axit sunfuric loãng, hãy viết các phương trình hóa học của phản ứng điều chế magie sunfat.
* Lời giải bài 1 trang 14 sgk hóa 9:
– Các phương trình phản ứng:
Mg + H2SO4 → MgSO4 + H2↑
MgO + H2SO4 → MgSO4 + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
Bài 2 trang 14 sgk hóa 9: Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam
c) Dung dịch có màu vàng nâu
d) Dung dịch không có màu.
Viết các phương trình hóa học.
* Lời giải bài 2 trang 14 sgk hóa 9:
a) Khí nhẹ hơn không khí và cháy được trong không khí là khí H2;
Mg + 2HCl → MgCl2 + H2↑
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II).
CuO + 2HCl → CuCl2 + H2O
c) Dung dịch có màu vàng nâu là dung dịch muối sắt (III)
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung dịch không có màu là dung dịch muối nhôm.
Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Bài 3 trang 14 sgk hóa 9: Hãy viết các phương trình hóa học của phản ứng trong mỗi trường hợp sau:
a) Magie oxit và axit nitric;
b) Đồng (II) oxit và axit clohiđric;
c) Nhôm oxit và axit sunfuric;
d) Sắt và axit clohiđric;
e) Kẽm và axit sunfuric loãng.
* Lời giải bài 3 trang 14 sgk hóa 9:
– Các phương trình phản ứng:
a) MgO + 2HNO3 → Mg(NO3)2 + H2O
b) CuO + 2HCl → CuCl2 + H2O
c) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
d) Fe + 2HCl → FeCl2 + H2↑
e) Zn + H2SO4 → ZnSO4 + H2↑
Bài tập 6 trang 19 sgk hóa 9: Cho một khối lượng mạt sắt dư vào 50ml dung dịch HCl. Phản ứng xong thu được 3,36 lít khí (DKTC).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch HCl đã dùng.
* Lời giải bài tập 6 trang 19 sgk hóa 9:
Xem Thêm : Tã bỉm hàng chính hãng, an toàn cho bé tại Bách Hóa XANH
a) PTPƯ: Fe + 2HCl → FeCl2 + H2↑
b) Từ PTPƯ ta thấy khí thu được là H2↑
Theo đề bài ta thu được 3,36 lít khí (ĐKTC) là của khí Hyđro nên ta có
(mol)
Theo PTPƯ: nFe = nH2 = 0,15 mol ⇒ mFe = 0,15. 56 = 8,4 (g)
c) Theo PTPƯ: nHCl = 2.nFe = 2 × 0,15 = 0,3 (mol), VHCl = 50ml = 0,05(lít)
nên ta có:
⇒ Vậy nồng độ mol của HCl là 6 (M)
Bài tập 7 trang 19 sgk hóa 9: Hòa tan hoàn toàn 12,1g hỗn hợp bột CuO và ZnO cần 100ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 có nồng độ 20 % để hòa tan hoàn toàn hỗn hợp các oxit trên.
* Lời giải bài tập 7 trang 19 sgk hóa 9:
Theo đề bài ta có: VHCl = 100ml = 0,1 lít ⇒ nHCl = CM . V = 0,1 . 3 = 0,3 mol
Gọi x và y là số mol CuO và ZnO trong hỗn hợp.
a) Phương trình hóa học xảy ra:
CuO + 2HCl → CuCl2 + H2O (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
b) Tính thành phần hỗn hợp, dựa vào phương trình phản ứng (1), (2) và dữ kiện đề bài cho ta có hệ phương trình đại số:
Theo PTPƯ (1): nHCl = 2. nCuO = 2.x mol;
Theo PTPƯ (2): nHCl = 2. nZnO = 2y mol;
Vì phản ứng xảy ra hoàn toàn (tức là HCl dùng hết 0,3 mol) nên:
⇒ nHCl = 2x + 2y = 0,3 (∗)
Ta có: mCuO = (64 + 16).x = 80x ; mZnO = (65 + 16).y = 81y
Vì phản ứng xảy ra hoàn toàn (tức là dùng hết 12,1 g hỗn hợp CuO và ZnO) nên:
⇒ mhh = 80x + 81y = 12,1. (∗∗)
Từ (∗) và (∗∗) ta có hệ phương trình
2x + 2y = 0,3 và
80x + 81y = 12,1
Giải hệ phương trình trên ta được: x = 0,05; y= 0,1.
⇒ nCuO = 0,05 mol, nZnO = 0,1 mol
mCuO = 80 . 0,05 = 4 g
%mCuO = (4. 100%) / 12,1 = 33%
%mZnO = 100% – 33% = 67%.
c) Khối lượng H2SO4 cần dùng:
CuO + H2SO4 → CuSO4 + H2O (3)
ZnO + H2SO4 → ZnSO4 + H2O (4)
Dựa vào phương trình (3) và (4), ta có:
Theo pt (3) 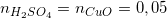
Theo pt (4) 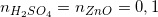
⇒ 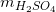
Khối lượng dung dịch H2SO4 20% cần dùng: 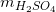
Bài tập 5 trang 21 sgk hóa 9: hoàn thành chuỗi PTPƯ
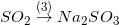
* Lời giải bài tập 5 trang 21 sgk hóa 9:
1) S + O2 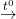
2) 2SO2 + O2 2SO3
3) SO2 + Na2O → Na2SO3
4) SO3 + H2O → H2SO4
5) 2H2SO4 (đ) + Cu 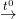
6) SO2 + H2O → H2SO3
7) H2SO3 + 2 NaOH → Na2SO3 + 2H2O
8) Na2SO3 + 2HCl → 2 NaCl + SO2↑ + H2O
9) H2SO4 + 2 NaOH → Na2SO4 + 2H2O
10) Na2SO4 + BaCl2 → BaSO4↓ + 2 NaCl
Bài tập 6 trang 33 sgk hóa 9: Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7 g AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
* Lời giải bài tập 6 trang 33 sgk hóa 9:
a) Phương trình phản ứng: CaCl2 + 2AgNO3 → 2AgCl↓trắng + Ca(NO3)2
– Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) = 40 + 35,5. 2 = 111g/mol ;
= 108 + 14 + 16.3 = 170g / mol
⇒ 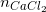
= 1,7/170 = 0,01 (mol)
Theo PTPƯ thì Tỉ lệ mol: nCaCl2 = 0,02/1 > 0,01/2 = nAgNO3
⇒ AgNO3 phản ứng hết, CaCl2 dư.
Theo pt: nAgCl = nAgNO3 = 0,01 (mol) ⇒ mAgCl = 0,01. 143,5 = 1,435 (g)
c) Chất còn lại sau phản ứng: Ca(NO3)2 và CaCl2 dư
Theo pt: nCaCl2 (pư) = (1/2). nAgNO3 = 0,01/2 = 0,005 mol
nCaCl2 (dư) = 0,02 – 0,005 = 0,015 (mol)
CM CaCl2 (dư) = 0,015/(0,03 + 0,07) = 0,15 (M)
nCa(NO3)2 = nAgNO3 = 0,005 (mol)
CM Ca(NO3)2 = 0,005/(0,03 + 0,07) = 0,05 (M)
Với hóa học vô cơ, các hợp chất của oxit, axit, bazơ đóng vai trò trọng yếu, vì vậy mà các em cần học thật kỹ bài học này, lấy đó làm cơ sở nền tảng để học tốt ở các bài học tiếp theo và đặc biệt là môn hóa ở bậc THPT.
Hy vọng với bài viết về tính chất hoá học của oxit, axit, bazo và muối ở trên sẽ giúp ích cho các em, mọi thắc mắc em em hãy để lại bình luận dưới bài viết để được hỗ trợ, chúc các em học tập tốt.
|
¤ Các bài cùng chương 1: » Bài 1: Tính Chất Hóa Học Của Oxit Và Khái Quát Về Sự Phân Loại Oxit » Bài 2: Một Số Oxit Quan Trọng » Bài 3: Tính Chất Hóa Học Của Axit » Bài 4: Một Số Axit Quan Trọng » Bài 5: Luyện Tập Tính Chất Hóa Học Của Oxit Và Axit ¤ Các bài viết khác cần xem: |
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Tính chất hoá học của Oxit, Axit, Bazo và Muối – Hoá lớp 9. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn



![small Sxrightarrow[]{(1)}SO_2xrightarrow[]{(2)}SO_3xrightarrow[]{(4)}H_2SO_4](https://hayhochoi.vn/uploads/news/wyswyg/2021_10/163550190581sv2r3a86.gif)
![small H_2SO_4xrightarrow[]{(5)}SO_2xrightarrow[]{(6)}H_2SO_3xrightarrow[]{(7)}Na_2SO_3xrightarrow[]{(8)}SO_2](https://hayhochoi.vn/uploads/news/wyswyg/2021_10/1635501909x2l4le7sgb.gif)