Cùng xem Tính chất hoá học của Sắt (Fe), ví dụ và bài tập – hoá lớp 9 trên youtube.
Sắt cũng là một trong những kim loại rất quen thuộc với chúng ta và được ứng dụng nhiều trong đời sống và sản xuất.
Sắt (Fe) cũng tương tự nhôm có tính dẫn điện sắt dẫn điện, dẫn nhiệt tốt nhưng kém nhôm, trong bài trước các em đã được giới thiệu về tính chất hoá học của nhôm, vậy trong bài này chúng ta cùng tìm hiểu về tính chất hoá học của sắt nhé.
Bạn đang xem: Tính chất hoá học của Sắt (Fe), ví dụ và bài tập – hoá lớp 9
I. Tính chất vật lý của Sắt (Fe)
– Sắt là kim loại màu trắng xám, có ánh kim dẫn điện, dẫn nhiệt tốt nhưng kém nhôm
– Sắt dẻo nên dễ rèn, sắt có tính nhiễm từ (bị nam châm hút và có thể trở thành nam châm)
– Sắt là kim loại nặng, khối lượng riêng 7,86g/cm3, nóng chảy ở nhiệt độ 15390C
II. Tính chất hoá học của Sắt (Fe)
* Sắt là kim loại có hoá trị II và III
- Sắt tác dụng với phi kim
- Sắt tác dụng với axit
- Sắt tác dụng với muối
- Sắt tác dụng với nước
1. Sắt tác dụng với phi kim
+ Khi đun nóng sắt tác dụng với hầu hết phi kim.
a) Sắt tác dụng với oxy
3Fe + 2O2 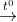
– Fe3O4 là oxit sắt từ, là oxit của hỗn hợp sắt có hóa trị II và III: FeO và Fe2O3
b) Sắt tác dụng với phi kim khác.
2Fe + 3Cl2
2FeCl3
– Ngoài Oxi (O) và Lưu huỳnh (S), sắt có thể tác dụng được với nhiều phi kim khác như Cl2, Br2,… tạo thành muối.
2. Sắt tác dụng với Axit
– Sắt tác dụng với HCl, H2S04 loãng tạo thành muối sắt (II) và giải phóng H2.
Fe + 2HCl loãng → FeCl2 + H2↑
Fe + 2H2SO4 loãng → FeSO4 + H2↑
Chú ý: Sắt Fe không phản ứng với axit HNO3 đặc, nguội và axit H2S04 đặc, nguội; do ở nhiệt độ thường, sắt tạo ra lớp oxit bảo vệ kim loại trở nên “thụ động”, không bị hòa tan.
– Sắt tác dụng với HNO3 đặc nóng, H2SO4 đặc nóng tạo thành muối sắt III
Fe + H2SO4 đặc,nóng → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 đặc,nóng → Fe(NO3)3 + 3NO2 + H2O
3. Tác dụng với dung dịch muối
– Sắt tác dụng với dung dịch muối của những kim loại kém hoạt động hơn trong dãy điện hoá, tạo thành dung dịch muối sắt và giải phóng kim loại trong muối
Fe + CuSO4 → FeSO4 + Cu
4. Tác dụng với nước
– Sắt hầu như không có phản ứng với nước lạnh, nhưng nếu cho Fe đi qua hơi nước ở nhiệt độ cao thì Fe khử H2O giải phóng H2
_ Khi t0C < 5700C: 3Fe + 4H2O → Fe3O4 + 4H2↑
_ Khi t0C > 5700C: Fe + H2O → FeO + H2↑
III. Bài tập vận dụng tính chất hoá học của Sắt Fe
Bài 1: Oxi hóa chậm m gam Fe ngoài không khí sau một thời gian thu được 12 gam hỗn hợp X (Fe, FeO, Fe2O3, Fe3O4). Để hòa tan hết X , cần vừa đủ 300 ml dung dịch HCl 1M, đồng thời giải phóng 0,672 lít khí (đktc). Tính m?
* Hướng dẫn:
Ta có các PTPƯ:
Fe + 2HCl → FeCl2 + H2↑
FeO + 2HCl → FeCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Theo bài ra, ta có: nH2 = 0,672/22,4= 0,03 mol.
nHCl = Cm.V = 0,3.1 = 0,3 mol
Ở bài này ta tính số mol theo nguyên tử Hyđro trong dung dịch axit
Ta có : nH+(trong HCl)= nH+(dùng để hoà tan oxit ) + nH+(khí thoát ra)
⇒ 0,3 = nH+(hoà tan oxit ) + 2.0,03
Xem Thêm : Đầu số 085 là mạng gì? Xem ý nghĩa và cách để sở hữu đầu số 085
⇒ nH+(dùng hoà tan oxit ) = 0,24 mol
nO(oxit) = ½ nH+(hoà tan oxit )= 0,12 mol
⇒ m = mX– mO(oxit) = 12 – 0,12.16 = 10,08 g
Bài 2: Cho m gam Fe tan vừa đủ trong dung dịch hỗn hợp HCl và FeCl3 thu được dung dịch X chỉ chứa một muối duy nhất và 5,6 lít H2 (đktc). Cô cạn dung dịch X thu được 85,09 gam muối khan. Hỏi m =?
* Hướng dẫn:
Theo bài ra ta có: nH2 = 5,6/22,4 = 0,25 mol
Cô cạn dung dịch thu được 85,09g là muối FeCl2
⇒ nFeCl2 = 85,09/127 = 0,67 mol
Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2↑ (1)
Fe + 2FeCl3 → 3FeCl2 (2)
Theo PTPƯ (1) thì: nFe = nFeCl2 = nH2 = 0,25 mol
⇒ nên FeCl2 tạo ra từ PTPƯ (2) là: 0,67 – 0,25 = 0,42
Theo PTPƯ (2) thì: nFe = (1/3) nFeCl2 = (1/3).0,42 = 0,14 mol
⇒ mFe = n.M = (0,14 + 0,25).56 = 0,39.56 = 21,84 g
Bài 4 trang 60 sgk hoá 9: Sắt tác dụng được với chất nào sau đây?
a) Dung dịch muối Cu(NO3)2
b) H2SO4 đặc, nguội
c) Khí Cl2
d) Dung dịch ZnSO4.
Viết các phương trình hóa học và ghi điều kiện, nếu có:
* Lời giải bài 4 trang 60 sgk hoá 9:
– Sắt tác dụng với dung dịch muối Cu(NO3)2 (a) và khí Cl2 (c):
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓
(kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối)
2Fe + 3Cl2 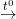
– Lưu ý: Sắt bị thụ động hóa trong môi trường H2SO4 đặc nguội và HNO3 đặc nguội.
Bài 5 trang 60 sgk hoá 9: Ngâm bột sắt dư trong 10ml dung dịch đồng sunfat 1M. Sau khi phản ứng kết thúc, lọc được chất rắn A và dung dịch B.
a) Cho A tác dụng với dung dịch HCl dư. Tính khối lượng chất rắn còn lại sau phản ứng.
b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B.
* Lời giải bài 5 trang 60 sgk hoá 9:
a) nCuSO4 = CM .V = 1. 0,01 = 0,01 (mol)
– PTHH: Fe + CuSO4 → FeSO4 + Cu↓ (1)
– Chất rắn A gồm sắt dư và đồng, dung dịch B là FeSO4.
nCu = nCuSO4 = 0,01 mol
– PTHH cho A + dd HCl:
Fe + 2HCl → FeCl2 + H2↑ (2)
Cu + HCl → không phản ứng.
– Khối lượng chất rắn còn lại sau phản ứng với HCl chỉ có Cu
mCu = 0,01.64 = 0,64 (g).
b) Dung dịch B chỉ có FeSO4:
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4 (3)
– Theo ptpư (1): nFeSO4 = nCuSO4 = 0,01 (mol).
– Theo ptpư (3): nNaOH = 2.nFeSO4 = 2.0,01 = 0,02 (mol).
⇒ VNaOH = n/CM = 0,02/1 = 0,02 (l).
Xem Thêm : Sự khác biệt giữa Pinocytosis và Phagocytosis
Bài 4 trang 69 sgk hoá 9: Hoàn thành chuỗi phản ứng
b) Fe → FeSO4 → Fe(OH)2 → FeCl2
c) FeCl3 → Fe(OH)3 → Fe2O3 → Fe → Fe3O4
* Lời giải bài 4 trang 69 sgk hoá 9:
b) Ta có chuỗi phương trình phản ứng:
1) Fe + H2SO4 → FeSO4 + H2↑
2) FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
3) Fe(OH)2 + 2HCl → FeCl2 + 2H2O
c) Ta có chuỗi phương trình phản ứng:
1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
2) 2Fe(OH)3 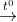
3) Fe2O3 + 3H2 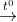
Hoặc: Fe2O3 + 2Al 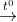
Hoặc: Fe2O3 + 3CO → 2Fe + 3CO2
4) Fe + O2
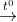
Bài 6 trang 69 sgk hóa 9: Ngâm một lá sắt có khối lượng 2,5 gam trong 25 ml dung dịch CuSO4 15% có khối lượng riêng là 1,12 g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô thì cân nặng 2,58 gam.
a) Hãy viết phương trình hoá học.
b) Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
* Lời giải bài 6 trang 69 sgk hóa 9:
a) PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
1 mol 1 mol 1 mol 1 mol
b) Theo PTPƯ cứ 1 mol Fe phản ứng tạo thành 1 mol Cu thì khối lượng thanh Fe tăng thêm là : 64 – 56 = 8 (g)
Gọi số mol Fe tham gia phản ứng là x
Theo bài ra số gam tăng lên sau khi lấy lá thép ra là: 2,58 – 2,5 = 0,08 (g)
⇒ x = (0,08.1)/8 = 0,01 (mol)
nFeSO4 = 0,01 mol ⇒ mFeSO4 = 0,01.152 = 1,52 (g)
mdd CuSO4 = D . V = 1,12.25 = 28 (g)
⇒ mCuSO4 = mdd.C% = 28.(15/100) = 4,2 (g)
⇒ nCuSO4 = 4,2/160 = 0,02625 (mol)
⇒ CuSO4 dư và nCuSO4 dư = 0,02625 – 0,01 = 0,01625 (mol)
– Chất sau phản ứng là: FeSO4 và CuSO4 dư
⇒ mCuSO4 dư = 0,01625.160 = 2,6 (g)
⇒ mdd sau pư = 28 +2,5 – 2,58 = 27,92 (g)
⇒ C% FeSO4 = (1,52/27,92). 100 = 5,4441 (%)
⇒ C% CuSO4 dư = (2,6/27,92). 100 = 9,3123 (%)
Hy vọng với phần hệ thống lại kiến thức về tính chất hoá học của Sắt Fe ở trên sẽ giúp ích cho các em, mọi thắc mắc và góp ý, các em hãy để lại bình luận dưới bài viết để được hỗ trợ, chúc các em học tập tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Tính chất hoá học của Sắt (Fe), ví dụ và bài tập – hoá lớp 9. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn