Cùng xem Tính chất hóa học của Bazơ, Bazo mạnh và bazo yếu – hóa 9 bài 7 trên youtube.
Chúng ta đã biết có 2 loại bazo, đó là bazơ tan được trong nước như NaOH, KOH,… và loại bazơ không tan được trong nước như Al(OH)3 , Fe(OH)3 , Cu(OH)2 ,… vậy giữa các bazơ này có tính chất hóa học nào khác nhau?
Để giải đáp câu hỏi trên và một số câu hỏi như: bazơ nào mạnh, bazơ nào yếu? bazơ tan trong nước và bazơ không tan trong nước có tính chất hóa học nào khác nhau? chúng ta cùng tìm hiểu chi tiết qua bài viết dưới đây.
Bạn đang xem: Tính chất hóa học của Bazơ, Bazo mạnh và bazo yếu – hóa 9 bài 7
I. Khái quát về Bazo – Bazo là gì?
– Bazo là gì? Bazơ là hợp chất hóa học mà trong đó phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit.
– Có công thức chung của Bazo có dạng B(OH)x, trong đó x là hóa trị của kim loại.
Ví dụ: NaOH : Natri hidroxit; Cu(OH)2 : Đồng hidroxit; Fe(OH)3 : Sắt (III) hidroxit
– Bazơ có 5 tính chất hóa học đặc trưng
- Làm đổi màu quỳ tím
- Tác dụng với axit
- Tác dụng với oxit axit
- Tác dụng với dung dịch muối
- Bazo không tan bị nhiệt phân
II. Tính chất hóa học của Bazo
1. Bazo tác dụng với chất chỉ chỉ màu
– Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
– Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2. Bazo tác dụng với Axit (Bazo + Axit)
– PTPƯ: Bazo + Axit → Muối + Nước
– Bazơ tan và không tan tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
3. Bazo tác dụng với Oxit axit (Bazo + oxit axit)
– PTPƯ: Bazo + Oxit axit → Muối + Nước
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ trắng + 3H2O
Ba(OH)2 + CO2 → BaCO3↓ trắng + H2O
4. Bazo tác dụng với muối
– PTPƯ: Bazo + Muối → Muối mới + Bazo mới
– Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓ xanh
5. Bazo không tan bị nhiệt phân hủy
– Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.
Ví dụ: Cu(OH)2 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1552783504hmiyhqdo3v_1630714649_1630796712.gif)
Xem Thêm : giấy mời họp phụ huynh đầu năm
2Al(OH)3 ![small xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2021_09/1552783504hmiyhqdo3v_1630714649_1630796712.gif)
* Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
III. Bazo mạnh, bazo yếu
– Một số Bazo mạnh như: NaOH, KOH,…
– Một số Bazo yếu như: Al(OH)3, Fe(OH)3, Cu(OH)2,…
IV. Bài tập Bazo
Bài 2 trang 25 SGK Hóa 9: Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào:
a) Tác dụng được với dung dịch HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quỳ tím thành xanh?
Viết các phương trình hóa học.
* Lời giải bài 2 trang 25 SGK Hóa 9:
a) Tất cả các bazơ đã cho đều phản ứng với dung dịch HCl.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + H2O
b) Bị phân hủy ở nhiệt độ cao là các bazo không tan : Cu(OH)2
Cu(OH)2 CuO + H2O
c) Tác dụng với CO2 là các dung dịch bazo (kiểm) NaOH, Ba(OH)2
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
2CO2 + Ba(OH)2 → Ba(HCO3)2
d) Đổi màu quỳ tím thành xanh: các kiềm NaOH, Ba(OH)2.
Bài 3 trang 25 SGK Hóa 9: Từ những chất có sẵn là: Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
* Lời giải bài 3 trang 25 SGK Hóa 9:
– Điều chế các dung dịch bazơ (kiềm):
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2.
Xem Thêm : Lời bài hát Breakfast – DH, GDucky, Minh
Bài 4 trang 25 SGK Hóa 9: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2 và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
* Lời giải bài 4 trang 25 SGK Hóa 9:
– Trích mẫu thử và đánh số thứ tự:
– Cho quỳ tím vào từng mẫu thử của các dung dịch trên, kết quả chia làm hai nhóm:
• Nhóm I: Quỳ tím đổi màu thành xanh: Ba(OH)2 và NaOH.
• Nhóm II: Quỳ tím không đổi màu: NaCl và Na2SO4.
– Phân biệt các chất trong các nhóm: Lấy từng chất của nhóm I đổ vào từng chất của nhóm II, ta nhận thấy có hai chất đổ vào nhau cho kết tủa trắng là Ba(OH)2 và Na2SO4 hai chất còn lại không phản ứng là NaOH và NaCl.
– PTPƯ: Ba(OH)2 + Na2SO4 → BaSO4 ↓ trắng + 2NaOH.
Bài 5 trang 25 SGK Hóa 9: Cho 15,5g natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20%, có khối lượng riêng 1,4 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
* Lời giải bài 5 trang 25 SGK Hóa 9:
– Theo bài ra, ta có: nNa2O = m/M = 15,5/62 = 0,25 (mol).
a) Phương trình phản ứng:
Na2O + H2O → 2NaOH
– Theo PTPƯ: nNaOH = 2.nNa2O = 2.0,25 = 0,5 (mol).
– Nồng độ mol của dd bazo là:
b) Phương trình phản ứng:
2NaOH + H2SO4 → Na2SO4 + 2H2O
– Theo PTPƯ: nH2SO4 = (1/2).nNaOH = (1/2).0,5 = 0,25 (mol).
⇒ mH2SO4 = n.M = 0,25.98 = 24,5 (g).
– Từ công thức tính nồng độ phần trăm của dd:
C%=% ⇒ mdd (H2SO4) = mct/C% = (24,5/20%) = (24,5.100)/20 = 122,5 (g).
– Ta lại có, khối lượng riêng: 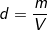
Hy vọng với bài viết về tính chất hóa học của bazo, bazo mạnh, bazo yếu và bài tập về bazo ở trên đã giải đáp phần nào được câu hỏi của các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
|
¤ Nội dung cùng chương 1: » Bài 6: Thực Hành Tính Chất Hóa Học Của Oxit Và Axit ¤ Có thể bạn muốn xem: |
Đăng bởi: DONGNAIART
Chuyên mục: Giáo Dục
Nguồn: https://dongnaiart.edu.vn
Danh mục: Tin tức
Lời kết: Trên đây là bài viết Tính chất hóa học của Bazơ, Bazo mạnh và bazo yếu – hóa 9 bài 7. Hy vọng với bài viết này bạn có thể giúp ích cho bạn trong cuộc sống, hãy cùng đọc và theo dõi những bài viết hay của chúng tôi hàng ngày trên website: Dongnaiart.edu.vn